Lời giải bài tập Hóa học lớp 10 Bài 10: Quy tắc Octet sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 10 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 10: Quy tắc Octet
Video giải Hóa học 10 Bài 10: Quy tắc Octet - Kết nối tri thức
Giải hóa học 10 trang 49 Kết nối tri thức
Phương pháp giải:
Các nguyên tử khi liên kết với nhau có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Hầu hết nguyên tử các nguyên tố trong bảng tuần hoàn đều không đủ 8 electron lớp ngoài cùng nên có xu hướng đạt cấu hình electron bền vững bằng cách kết hợp với các nguyên tử khác theo tỉ lệ nhất định.
I. Khái niệm liên kết hóa học
Phương pháp giải:
Cấu hình electron của F: 1s22s22p5
Cấu hình electron của F khi nhận thêm 1 electron: 1s22s22p6.
Lời giải:
Khi nguyên tử F nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố Ne.
Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững.
Lời giải:
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Giải hóa học 10 trang 50 Kết nối tri thức
II. Quy tắc Octet
Phương pháp giải:
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm ( trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
- Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử F2 được biểu diễn
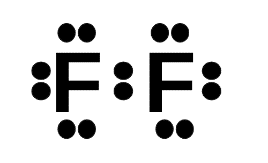
Xung quanh mỗi nguyên tử fluorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử CCl4, nguyên tử carbon có 4 electron hóa trị, nguyên tử carbon cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung một 1 electron. Phân tử CCl4 được biểu diễn

Xung quanh mỗi nguyên tử carbon và chlorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử NF3, nguyên tử nitrogen có 5 electron hóa trị, nguyên tử nitrogen cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử NF3 được biểu diễn
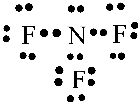
Xung quanh mỗi nguyên tử nitrogen và florine đều có 8 electron
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Phương pháp giải:
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm ( trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Lời giải:
- Khi hình thành liên kết hóa học trong phân tử PH3, nguyên tử phosphorus có 5 electron hóa trị, nguyên tử phosphorus cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử hydrogen góp chung một 1 electron. Phân tử PH3 được biểu diễn
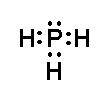
Xung quanh mỗi nguyên tử phosphorus đều có 8 electron.
Lý thuyết Quy tắc octet
I. Khái niệm liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Ví dụ:
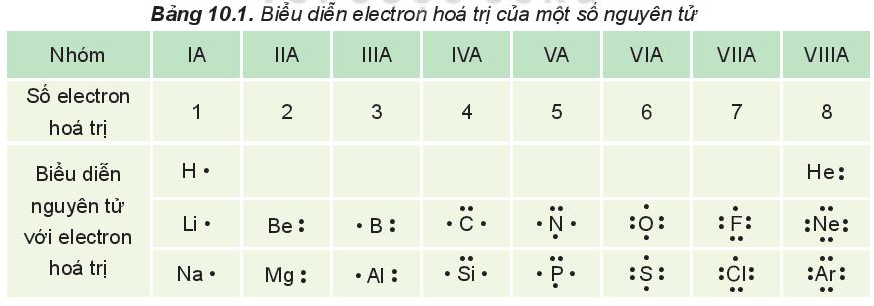
II. Quy tắc octet
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Ví dụ 1: Xét sự hình thành liên kết hóa học trong phân tử Cl2.
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5.
Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
Phân tử Cl2 được biểu diễn:

Xung quanh mỗi nguyên tử Cl đều có 8 electron.
Ví dụ 2: Xét sự hình thành liên kết hóa học trong phân tử NaF.
Cấu hình electron của nguyên tử:
Na (Z = 11): [Ne]3s1 có 1 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng.
Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
Bài giảng Hóa học 10 Bài 10: Quy tắc Octet - Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: