Với giải sách bài tập Hoá học 10 Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Nhận biết
A. 1s22s22p6
B. 1s22s22p63s23p1
C. 1s22s22p63s3
D. 1s22s22p63s2
Lời giải:
Đáp án đúng là: D
Nguyên tố X ở chu kì 3 ⇒ Có 3 lớp electron.
Nguyên tố X thuộc nhóm IIA ⇒ Lớp ngoài cùng có 2 electron.
⇒ 1s22s22p63s2
A. ô số 17, chu kì 4, nhóm IA.
B. ô số 24, chu kì 4, nhóm VIB.
C. ô số 24, chu kì 3, nhóm VB
D. ô số 27, chu kì 4, nhóm IB.
Lời giải:
Đáp án đúng là: B
Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3d54s1. Suy ra:
- Số electron = vị trí của ô nguyên tố = 24.
- Có 4 lớp electron ⇒ thuộc chu kì 4.
- Có tổng số electron lớp ngoài cùng và phân lớp sát ngoài cùng là 6 ⇒ thuộn nhóm VIB.
Bài 8.3 trang 21 SBT Hóa học 10: Cho cấu hình electron nguyên tử của các nguyên tố sau
X (1s22s22p63s1); Y (1s22s22p63s2) và Z (1s22s22p63s23p1)
Dãy các nguyên tố xếp theo chiều tăng dần tính kim loại từ trái sang phải là
A. Z, Y, X
B. X, Y, Z
C. Y, Z, X
D. Z, X, Y
Lời giải:
Đáp án đúng là: A
Dựa vào cấu hình electron ta biết được X, Y, Z đều thuộc chu kì 3, số đơn vị điện tích hạt nhân tăng dần từ X, Y, Z.
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính kim loại giảm, tính phi kim tăng.
⇒Dãy các nguyên tố xếp theo chiều tăng dần tính kim loại từ trái sang phải là:
Z, Y, X.
A. Kim loại
B. Phi kim
C. Trơ của khí hiếm
D. Lưỡng tính
Lời giải:
Đáp án đúng là: B
Nguyên tử X nhận thêm 2 electron để trở thành ion X2-
⇒ Cấu hình electron của nguyên tử X là: [Ne]3s23p4
X có 6 electron hóa trị ⇒ là phi kim.
A. R2O3, R(OH)3 (đều lưỡng tính)
B. RO3 (acidic oxide), H2RO4 (acid).
C. RO2 (acidic oxide), H2RO3 (acid)
D. RO (basic oxide), R(OH)2 (base)
Lời giải:
Đáp án đúng là: A
Nguyên tử R nhường 3 electron để tạo thành cation R3+
⇒ Nguyên tử R có cấu hình electron ở phân lớp ngoài cùng là 3s23p1
Cấu hình electron đầy đủ của R là: 1s22s22p63s23p1
⇒ R thuộc ô số 13, chu kì 3, nhóm IIA trong bảng tuần hoàn.
⇒ Công thức oxide ứng với hóa trị cao nhất là R2O3 có tính lưỡng tính và hydroxide tương ứng của R là R(OH)3 có tính lưỡng tính.
Thông hiểu
A. X2O3, X(OH)3, tính lưỡng tính.
B. XO3, H2XO4, tính acid.
C. XO2, H2XO3, tính acid.
D. XO, X(OH)2, tính base.
Lời giải:
Đáp án đúng là: B
Nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 3p4
⇒ Cấu hình electron đầy đủ của X là: 1s22s22p63s23p4
⇒ X thuộc nhóm VIA
⇒ Hóa trị cao nhất trong hợp chất oxide và hydroxide của X là 6.
⇒ Công thức oxide ứng với hóa trị cao nhất của X là XO3 (có tính acid) và hydroxide là
H2XO4 (có tính acid).
A. X là kim loại; Y là chất lưỡng tính; Z là phi kim.
B. X là phi kim; Y là chất lưỡng tính; Z là kim loại.
C. X là kim loại; Z là chất lưỡng tính; Y là phi kim.
D. X là phi kim; Z là chất lưỡng tính; Y là kim loại.
Lời giải:
Oxide của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím ⇒ Oxide của X có tính acid ⇒ X là phi kim.
Oxide của Y phản ứng với nước tạo thành dung dịch làm xanh quỳ tím. ⇒ Oxide của Y có tính base ⇒ Y là kim loại.
Oxide của Z phản ứng được với cả acid lẫn base. ⇒ Oxide của Z có tính lưỡng tính.
Không có khái niệm kim loại lưỡng tính
⇒ Không có đáp án đúng.
Bài 8.8 trang 22 SBT Hóa học 10: Nguyên tố X nằm ở chu kì 4, nhóm VIIA của bảng tuần hoàn
a) Viết cấu hình electron nguyên tử của X.
b) Nguyên tử của X có bao nhiêu electron thuộc lớp ngoài cùng?
c) Electron lớp ngoài cùng thuộc những phân lớp nào?
d) X là kim loại hay phi kim?
Lời giải:
a) Nguyên tố X nằm ở chu kì 4 ⇒ Có 4 lớp electron.
Nguyên tố X thuộc nhóm VIIA của bảng tuần hoàn ⇒ Nguyên tử X có 7 electron lớp ngoài cùng.
⇒ Cấu hình electron nguyên tử của X là: 1s22s22p63s23p63d104s24p5
b) Nguyên tử X có 7 electron lớp ngoài cùng.
c) Nguyên tử X có 7 electron lớp ngoài cùng trong đó 2 electron thuộc phân lớp 4s và 5 electron thuộc phân lớp 4p.
d) Nguyên tử X dễ thu thêm 1 electron để đạt cấu hình octet. X là phi kim.
a) Viết cấu hình electron của chúng và xác định vị trí mỗi nguyên tố trong bảng tuần hoàn.
b) Xếp các nguyên tố trên theo thứ tự tính kim loại tăng dần. Giải thích.
Lời giải:
a) Cấu hình electron và vị trí nguyên tố trong bảng tuần hoàn.
5X: 1s22s22p1 ô số 5, nhóm IIIA, chu kì 2; nguyên tố p.
11Y: 1s22s22p63s1 ô số 11, nhóm IA, chu kì 3; nguyên tố s.
13Z: 1s22s22p63s23p1 ô số 13, nhóm IIIA, chu kì 3; nguyên tố p.
19T: 1s22s22p63s23p64s1; ô số 19, nhóm IA, chu kì 3; nguyên tố s.
b) Theo nhóm A: Y < T và X < Z; theo chu kì: Z < Y.
⇒ Thứ tự tăng dần tính kim loại: X < Z < Y < T.
a) Viết cấu hình electron của chúng và xác định vị trí mỗi nguyên tố trong bảng tuần hoàn.
b) Xếp các nguyên tố trên theo thứ tự tính phi kim giảm dần (biết độ âm điện của G lớn hơn A).
Lời giải:
a) Cấu hình electron và vị trí nguyên tố trong bảng tuần hoàn:
6A: 1s22s22p2; ô số 6, nhóm IVA, chu kì 2; nguyên tố p.
9D: 1s22s22p5; ô số 9, nhóm VIIA, chu kì 2; nguyên tố p.
14E. 1s22s22p63s23p2; ô số 14, nhóm IVA, chu kì 3; nguyên tố p.
17G: 1s22s22p63s23p5; ô số 17, nhóm VIIA, chu kì 3; nguyên tố p.
b) Theo nhóm A: tính phi kim A > E và D > G.
Theo chu kì: Tính phi kim D > A và G > E.
Độ âm điện của G > A nên tính phi kim G > A.
⇒ Thứ tự giảm dần tính phi kim: D > G > A > E.
Bài 8.11 trang 22 SBT Hóa học 10: Cấu hình electron theo lớp của năm nguyên tố X, Q, Z, A, D như sau
X: 2, 2; Q: 2, 8, 8, 2; Z: 2, 7;
A: 2, 8, 8, 7; D: 2
a) Nêu vị trí của mỗi nguyên tố trong bảng tuần hoàn.
b) Xác định kim loại mạnh nhất, phi kim mạnh nhất, nguyên tố kém hoạt động nhất trong số chúng. Giải thích.
Lời giải:
a) Vị trí trong bảng tuần hoàn.
|
X |
Q |
Z |
A |
D |
|
|
Số thứ tự |
4 |
20 |
9 |
25 |
2 |
|
Chu kì |
2 |
4 |
2 |
4 |
1 |
|
Nhóm |
IIA |
IIA |
VIIA |
VIIB |
VIIIA |
b) Kim loại mạnh nhất là Q, phi kim mạnh nhất là Z, nguyên tố kém hoạt động nhất là D.
- X, Q, D đều có 2 electron lớp ngoài cùng, nhưng D có cấu hình electron bão hòa là 1s2 nên không nhường hay nhận electron, X và Q ở cùng nhóm IIA của bảng tuần hoàn, theo xu hướng biến đổi trong nhóm A từ trên xuống dưới tính kim loại tăng nên tính kim loại Q > X.
- Z ở nhóm VIIA, là phi kim duy nhất và cũng là phi kim mạnh nhất.
- D là khí hiếm nên kém hoạt động nhất.
Vận dụng
a) Viết cấu hình electron của nguyên tử A. Xác định vị trí của A trong bảng tuần hoàn.
b) Viết công thức oxide ứng với hóa trị cao nhất, hydroxide tương ứng của A và nêu tính acid – base của chúng.
Lời giải:
Ta có: 2p + n = 108 và 2p – n =24
⇒ p = 33, A là 33As (arsenic).
a) Cấu hình electron: [18Ar]3d104s24p3
Vị trí của A trong bảng tuần hoàn: số thứ tự 33, nhóm VA, chu kì 4.
b) Công thức oxide ứng với hóa trị cao nhất của A là acidic oxide A2O5; hydroxide H3AO4 là acid.
a) Xác định cấu hình electron của nguyên tử M và nguyên tử Y.
b) Xác định vị trí của M, Y trong bảng tuần hoàn.
Lời giải:
M → M3+ + 3e
Y + 1e →Y-
a) Cấu hình electron của M là: [18Ar]3d64s2.
Cấu hình e của Y là: [18Ar]3d104s24p5
b) Vị trí của M trong bảng tuần hoàn: ô số 26, chu kì 4, nhóm VIIIB.
Vị trí của Y trong bảnh tuần hoàn: ô số 35, chu kì 4, nhóm VIIA.
a) Viết công thức hợp chất khí với hydrogen của các nguyên tố A và D.
b) Viết công thức oxide ứng với hóa trị cao nhất của A, D và hydroxide tương ứng. So sánh tính acid – base giữa các oxide, hydroxide đó. Giải thích.
Lời giải:
a) Công thức hợp chất khí với hydrogen của A và D có dạng AH4 và DH4.
Ta có: ⇒ A = 12 ⇒A là 6C (carbon)
Công thức hợp chất khí với hydrogen của A là CH4.
Ta có: ⇒ D = 28. ⇒D là 14Si (silicon)
Công thức hợp chất khí với hydrogen của D là SiH4.
b) Oxide cao nhất: CO2 và SiO2 đều là acidic oxide.
Hydrogen tương ứng: H2CO3, H2SiO3 đều là acid và tính acid H2CO3 mạnh hơn H2SiO3.
6C và 14Si nằm cùng nhóm IVA của bảng tuần hoàn. Trong một nhóm A, theo chiều từ trên xuống dưới tính acid của hydroxide tương ứng giảm dần (theo xu hướng biến đổi tính phi kim)
a) Xác định M và cho biết vị trí của M trong bảng tuần hoàn.
b) So sánh tính kim loại của M với 19K và 12Mg. Giải thích.
Lời giải:
a) Số mol khí = = ≈ 0,03 (mol).
M + 2HCl → MCl2 + H2↑
Số mol M = số mol khí = 0,03
⇒ M = = 40 (g/mol). M là Ca.
Vị trí trong bảng tuần hoàn của M: ô số 20, chu kì 4, nhóm IIA.
Cấu hình electron của M: [18Ar]4s2.
b) Tính kim loại: 20Ca < 19K (trong cùng chu kì, từ trái sang phải tính kim loại giảm).
Tính kim loại: 20Ca > 12Mg (trong cùng nhóm A, từ trên xuống dưới tính kim loại tăng).
Bài giảng Hóa học 10 Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học - Kết nối tri thức
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
I. Định luật tuần hoàn
Nội dung của định luật tuần hoàn: “Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử”.
II. Ý nghĩa của bảng tuần hoàn
Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron nguyên tử, từ đó dự đoán được tính chất hóa học của các nguyên tố.
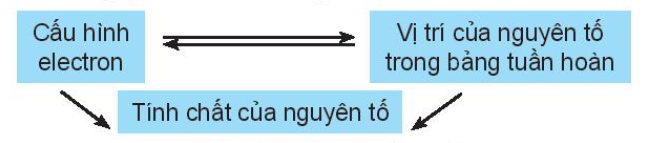
Chú ý: Từ vị trí của nguyên tố trong bảng tuần hoàn, có thể:
- Viết được cấu hình electron của nguyên tử và ngược lại.
- Dự đoán được tính chất (tính kim loại, tính phi kim) của nguyên tố đó.
- Viết được công thức oxide, hydroxide và nêu tính acid, base tương ứng.
Ví dụ 1: Nguyên tố chlorine (Cl) ở ô số 17, nhóm VIIA, chu kì 3.
- Nguyên tử Cl có:
+ 17 proton, 17 electron (do số proton = số electron = Z).
+ 3 lớp electron (do số lớp electron = số thứ tự chu kì).
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng = số thứ tự nhóm A).
Cấu hình electron của Cl: 1s22s22p63s23p5. Cl là nguyên tố phi kim. Oxide cao nhất (Cl2O7) là acidic oxide và acid tương ứng HClO4 là acid mạnh.
Ví dụ 2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
- Nguyên tử P có Z = 15 (do số proton = số electron = Z).
- Nguyên tố P ở chu kì 3, nhóm VA (do có 3 lớp electron và có 5 electron ở lớp ngoài cùng).
- P là nguyên tố phi kim. Oxide cao nhất (P2O5) là acidic oxide và acid tương ứng là (HPO3 hay H3PO4) là acid trung bình.
Ví dụ 3: So sánh tính phi kim của P (Z = 15), O (Z = 8) và S (Z = 16).
P (Z = 15): 1s22s22p63s23p3 Nguyên tố P thuộc chu kì 3, nhóm VA.
O (Z = 8): 1s22s22p4 Nguyên tố O thuộc chu kì 2, nhóm VIA.
S (Z = 16): 1s22s22p63s23p4 Nguyên tố S thuộc chu kì 3, nhóm VIA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần Tính phi kim: P < S.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần Tính phi kim: S < O.
Vậy tính phi kim: P < S < O.