Với Giải hóa học lớp 10 trang 73 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 73 Chân trời sáng tạo
Câu hỏi 2 trang 73 Hóa học 10: Quan sát Hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chlorine (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl

Phương pháp giải:
Trong phân tử HCl, mỗi nguyên tố bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung
Lời giải:
- Trong phân tử HCl, mỗi nguyên tử bỏ ra 1 electron để góp chung tạo thành 1 cặp electron dùng chung
- Khi 1 cặp electron lệch hẳn về Cl
=> Có thể coi Cl nhận 1 electron và H nhường 1 electron
=> Cl sẽ mang điện tích -1 và H mang điện tích +1
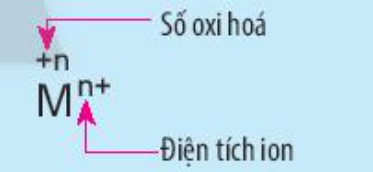
Câu hỏi 3 trang 73 Hóa học 10: Nêu điểm khác nhau giữa kí hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau:
Phương pháp giải:
Quan sát hình vẽ và rút ra nhận xét
Lời giải:
- Kí hiệu số oxi hóa: Dấu rồi đến số (+n)
Ví dụ: +1, +2, -1, -2
- Kí hiệu điện tích ion: Số rồi đến dấu (n-). Với điện tích có giá trị là 1 thì không cần ghi số 1
Ví dụ: Cl-, O2-, Na+, Ca2+.
Câu hỏi 4 trang 73 Hóa học 10: Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích
Phương pháp giải:
Quy tắc 4: Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1, kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm (aluminium) có số oxi hóa +3
Lời giải:
- Nguyên tử nhóm IA có 1 electron ở lớp ngoài cùng, có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +1
- Nguyên tử nhóm IIA có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +2
- Nguyên tử nhóm IIIA có 3 electron ở lớp ngoài cùng, có xu hướng nhường 3 electron để đạt cấu hình electron bền vững của khí hiếm => Sẽ có số oxi hóa là +3
Luyện tập trang 73 Hóa học 10: Hãy xác định số oxi hóa của các nguyên tử trong các đơn chất, hợp chất và ion sau: Zn, H2, Cl-, O2-, S2-, HSO4-, Na2S2O3, KNO3
Phương pháp giải:
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0
- Quy tắc 2: Trong 1 phân tử, tổng số oxi góa của các nguyên tử = 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó
- Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3
Lời giải:
- Zn là đơn chất => Số oxi hóa của nguyên tử Zn là 0
- H2 là đơn chất => Số oxi hóa của nguyên tử H trong H2 là 0
- Cl- là ion đơn nguyên tử có điện tích là 1- => Số oxi hóa của ion Cltrong Cl- là -1
- O2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Otrong O2- là -2
- S2- là ion đơn nguyên tử có điện tích là 2- => Số oxi hóa của ion Strong S2- là -2
- HSO4-: gọi số oxi hóa của S trong ion là x.
Ta có: (+1).1 + x.1 + (-2).4 = -1
=> x = +6
Vậy số oxi hóa của H = +1, O = -2 và S = +6
- Na2S2O3: gọi số oxi hóa của S trong phân tử là x
Ta có: (+1).2 + x.2 + (-2).3 = 0
=> x = +2
Vậy số oxi hóa của Na = +1, S = +2, O = -2
KNO3: gọi số oxi hóa của N trong phân tử là x
Ta có: (+1).1 + x.1 + (-2).3 = 0
=> x = +5
Vậy số oxi hóa của K = +1, N = +5, O = -2
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: