Với Giải hóa học lớp 10 trang 66 Chân trời sáng tạo chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 79 Chân trời sáng tạo
Bài 1 trang 79 Hóa học 10: Tính số oxi hóa của nguyên tử có đánh dấu * trong các chất và ion dưới đây

Phương pháp giải:
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất = 0
- Quy tắc 2: Trong 1 phân tử, tổng số oxi góa của các nguyên tử = 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) = điện tích của ion đó
- Quy tắc 4: Trong hợp chất, H chủ yếu +1, O là -2, nhóm IA là +1, nhóm IIA là +2, Al là +3
Lời giải:
a)
- K2Cr2O7: Gọi số oxi hóa của Cr trong K2Cr2O7 là x
=> (+1).2 + x.2 + (-2).7 = 0
=> x = +6
=> Số oxi hóa của Cr trong K2Cr2O7 là +6
- KMnO4: Gọi số oxi hóa của Mn trong KMnO4 là x
=> (+1).1 + x.1 + (-2).4 = 0
=> x = +7
=> Số oxi hóa của Mn trong KMnO4 là +7
- KClO4: Gọi số oxi hóa của Cl trong KClO4 là x
=> (+1).1 + x.1 + (-2).4 = 0
=> x = +7
=> Số oxi hóa của Cl trong KClO4 là +7
- NH4NO3: Gọi số oxi hóa của N cần tìm là x
=> x.1 + (+1).1 + (+5).1 + (-2).3 = 0
=> x = -3
=> Số oxi hóa của N cần tìm trong NH4NO3 là -3
b)
- AlO2-: Gọi số oxi hóa của Al trong AlO2- là x
=> x.1 + (-2).2 = -1
=> x = +3
=> Aố oxi hóa của Al trong AlO2- là +3
- PO43-: Gọi số oxi hóa của P trong PO43- là x
=> x.1 + (-2).4 = -3
=> x = +5
=> Số oxi hóa của P trong PO43- là +5
- ClO3-: Gọi số oxi hóa của Cl trong ClO3- là x
=> x.1 + (-2).3 = -1
=> x = +5
=> Số oxi hóa của Cl trong ClO3- là +5
- SO42-: Gọi số oxi hóa của S trong SO42- là x
=> x.1 + (-2).4 = -2
=> x = +6
=> Số oxi hóa của S trong SO42- là +6
Bài 2 trang 79 Hóa học 10: Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp
a)
b)
c)
d)
Phương pháp giải:
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
a)
Bước 1:
Bước 2:
Quá trình oxi hóa: 2Cl-1 → Cl20 + 2e
Quá trình khử: Mn+4 + 2e → Mn+2
Chất oxi hóa là Mn trong MnO2 vì Mn nhận electron
Chất khử là Cl trong HCl vì Cl nhường electron
Bước 3: Xác định hệ số
|
1 x |
2Cl-1 → Cl20 + 2e |
|
1 x |
Mn+4 + 2e → Mn+2 |
Bước 4: Đặt hệ số
b)
Bước 1:
Bước 2:
Quá trình oxi hóa: N+3 → N+5 + 2e
Quá trình khử: Mn+7 + 5e → Mn+2
Chất oxi hóa là Mn trong KMnO4 vì Mn nhận electron
Chất khử là N trong KNO2 vì N nhường electron
Bước 3: Xác định hệ số
|
5 x |
N+3 → N+5 + 2e |
|
2 x |
Mn+7 + 5e → Mn+2 |
Bước 4: Đặt hệ số
c)
Bước 1:
Bước 2:
Quá trình oxi hóa: 3Fe+8/3 → 3Fe+3 + e
Quá trình khử: N+5 + 3e → N+2
Chất oxi hóa là N trong HNO3 vì N nhận electron
Chất khử là Fe trong Fe3O4 vì Fe nhường electron
Bước 3: Xác định hệ số
|
3 x |
3Fe+8/3 → 3Fe+3 + e |
|
1 x |
N+5 + 3e → N+2 |
Bước 4: Đặt hệ số
d)
Bước 1:
Bước 2:
Quá trình oxi hóa: 2C+1 → 2C+4 + 6e
Quá trình khử: Mn+7 + 5e → Mn+2
Chất oxi hóa là Mn trong KMnO4 vì Mn nhận electron
Chất khử là C trong C2H2O2 vì C nhường electron
Bước 3: Xác định hệ số
|
5 x |
2C+1 → 2C+4 + 6e |
|
6 x |
Mn+7 + 5e → Mn+2 |
Bước 4: Đặt hệ số
Bài 3 trang 79 Hóa học 10: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa - khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron.
Phương pháp giải:
- Xác định những hiện tượng hóa học có xảy ra phản ứng oxi hóa - khử trong cuộc sống hàng ngày
- Viết và cân bằng các phương trình hóa học đó theo phương pháp thăng bằng electron
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
- Hiện tượng gỉ sét: sắt thép để lâu ngày trong không khí thì trên bề mặt của chúng sẽ xuất hiện lớp màu nâu đỏ
Sơ đồ phản ứng:
Quá trình oxi hóa:
Quá trình khử:
|
1x |
|
|
2x |
|
Phương trình hóa học: 3Fe + 2O2 → Fe3O4
- Hiện tượng sự cháy của cây nến: nến có thành phần chính là paraffin, khi cháy trong không khí sẽ sinh ra khí carbon dioxide và hơi nước
Sơ đồ phản ứng: C2H6 + O2 → CO2 + H2O
|
2x |
|
|
7x |
|
Phương trình hóa học: 2C2H6 + 7O2 → 4CO2 + 6H2O
Bài 4 trang 79 Hóa học 10: Viết phương trình hóa học của phản ứng điều chế muối zinc chloride (ZnCl2) bằng một phản ứng oxi hóa - khử và một phản ứng không phải là phản ứng oxi hóa - khử
Phương pháp giải:
- Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản u nwgs có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
- Phản ứng không phải là phản ứng oxi hóa khử là các nguyên tử trong phân tử không thay đổi số oxi hóa
Lời giải:
- Phản ứng oxi hóa - khử: Zn + Cl2 → ZnCl2
+ Zn từ số oxi hóa 0 lên +2, Cl từ số oxi hóa 0 xuống -1
- Phản ứng không phải oxi hóa - khử: ZnO + 2HCl → ZnCl2 + H2O
Bài 5 trang 79 Hóa học 10: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200oC, ammonium perchlorate nổ theo phản ứng sau:
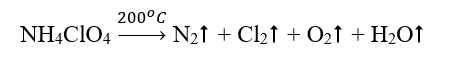
Lập phương trình hóa học của phản ứng bằng phương pháp thăng bằng electron.
Phương pháp giải:
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Sơ đồ phản ứng:
Quá trình oxi hóa:
Quá trình khử:
|
1x |
ð Tổng: 14 e nhường |
|
1x |
|
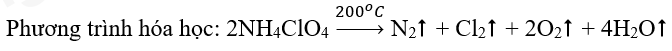
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: