Với giải Câu hỏi 12 trang 98 Hóa học lớp 12 Chân trời sáng tạo chi tiết trong Bài 17: Nguyên tố nhóm IA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 17: Nguyên tố nhóm IA
Câu hỏi 12 trang 98 Hóa học 12: Vì sao phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia. Nêu những ưu điểm của phương pháp.
Phương pháp giải:
- Phương pháp Solvay (mang tên nhà hoá học Ernest Solvay) sử dụng nguồn nguyên liệu dễ tìm trong tự nhiên là muối ăn (NaCl), đá vôi (CaCO3) và ammonia (NH3).
- Quá trình diễn ra như sau:
+ Hoà tan NaCl vào dung dịch NH3 đặc đến bão hoà.
+ Nung CaCO3 rồi dẫn khí thoát ra vào dung dịch bão hoà của NaCl trong NH3:
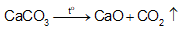
+ Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước. Tách NaHCO3 khỏi dung dịch, nung ở nhiệt độ cao, thu được soda:
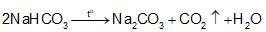
+ Sản phẩm NH4Cl được chế hoá với vôi tôi, thu khí NH3:
Lời giải:
- Trong phương pháp Solvay, vì ammonia được đưa vào rồi sử dụng lại nên phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia.
- Ưu điểm:
+ Nguyên liệu sản xuất rẻ.
+ Các phản ứng được thực hiện ở nhiệt độ không cao, áp suất gần với áp suất khí quyển.
+ Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
+ Quá trình sản xuất được thực hiện liên tục trong dòng nguyên liệu khí – lỏng là chủ yếu, do đó dễ cơ giới hóa và tự động hóa sản xuất.
+ Soda và baking soda thu được có độ tinh khiết cao.
Lý thuyết Hợp chất
1. Tính tan
- Phần lớn các hợp chất của kim loại nhóm IA tan tốt trong nước, khi tan trong nước phân li thành ion.
2. Nhận biết ion
Có thể nhận biết ion kim loại kiềm bằng cách thử màu ngọn lửa.
+ Muối của lithium cháy cho ngọn lửa màu đỏ tía.
+ Muối của sodium cháy cho ngọn lửa màu vàng.
+ Muối của potassium cháy cho ngọn lửa màu tím nhạt.
3. Sodium chloride
NaCl là hợp chất phổ biến nhất của sodium trong tự nhiên, được khai thác từ nước biển, muối mỏ.
- NaCl có vai trò quan trọng trong thực phẩm, nông nghiệp, công nghiệp, chăn nuôi, y tế và trong cuộc sống hằng ngày của con người
4. Điện phân dung dịch sodium chloride
- Điện phân dung dịch NaCl bão hòa có màng ngăn tạo ra các sản phẩm cơ bản của công nghiệp chlorine – kiềm: sodium hydroxide, chlorinde vvà hydrogen.
5. Sodium hydrogencarbonate, sodium carbonate
1. Sodium hydrogencarbonate
- NaHCO3 còn gọi là baking soda, là chất rắn màu trắng, bền ở nhiệt độ thường, bị phân hủy khi đun nóng.
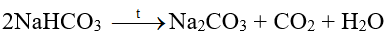
NaHCO3 có thể tác dụng được với dung dịch acid và dung dịch kiềm:
NaHCO3 + HCl NaCl + CO2 + H2O
NaHCO3 + NaOH Na2CO3 + H2O
NaHCO3 được sử dụng trong chế biến thực phẩm, trong sản xuất thủy tinh,…
- Trong y học, NaHCO3 được sử dụng để làm giảm chứng đau dạ dày, do dư acid, điều trị các triệu chứng viêm loét dạ dày hoặc tá tràng.
2. Sodium carbonate
- Na2CO3 được gọi là soda, là chất rắn màu trắng, dễ tan trong nước.
- Một lượng lớn Na2CO3 được sử dụng trong công nghiệp thủy tinh.
3. Phương pháp Solvay
- Phương pháp Solvay dùng để sản xuất soda và baking soda
Quá trình cụ thể
(1) Hòa tan NaCl vào dung dịch NH3 đặc đến bão hòa.
(2) Nung CaCO3 rồi dẫn khí thoát ra vào dung dịch bão hòa của NaCl trong NH3
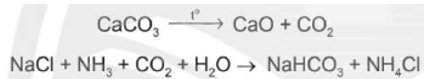
(3) Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước. Tách NaHCO3 khỏi dung dịch, nung ở nhiệt độ cao, thu được soda:
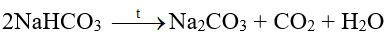
(4) Sản phẩm NH4Cl được chế hóa với vôi tôi, thu khí NH3:
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3 + 2H2O
Xem thêm lời giải bài tập Hóa học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 93 Hóa học 12: Vì sao kim loại nhóm IA có khối lượng riêng nhỏ và độ cứng thấp?...
Câu hỏi 7 trang 94 Hóa học 12: Kim loại nhóm IA hoạt động hóa học mạnh. Tại sao?...
Câu hỏi 11 trang 97 Hóa học 12: Giải thích tại sao NaHCO3 được dùng làm bột nở....
Luyện tập trang 98 Hóa học 12: Hãy vẽ sơ đồ tổng hợp Na2CO3 theo phương pháp Solvay....
Bài 1 trang 99 Hóa học 12: Phương pháp điều chế NaOH trong công nghiệp là...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Chân trời sáng tạo hay, chi tiết khác:
Bài 15. Các phương pháp tách kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Đại cương về kim loại chuyển tiếp dãy thứ nhất
Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch