Với giải sách bài tập Khoa học tự nhiên 8 Bài 2: Phản ứng hóa học sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 8. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên 8 Bài 2: Phản ứng hóa học
Bài 2.1 trang 5 Sách bài tập KHTN 8: Quá trình nào sau đây là biến đổi hoá học?
A. Đốt cháy cồn trong đĩa.
B. Hơ nóng chiếc thìa inox.
C. Hoà tan muối ăn vào nước.
D. Nước hoa trong lọ mở nắp bị bay hơi.
Lời giải:
Đáp án đúng là: A
Quá trình biến đổi hoá học: Đốt cháy cồn trong đĩa.
Do quá trình này có sự tạo thành chất mới.
Bài 2.2 trang 5 Sách bài tập KHTN 8: Quá trình nào sau đây chỉ xảy ra biến đổi vật lí?
A. Đốt cháy củi trong bếp.
B. Thắp sáng bóng đèn dây tóc.
C. Đốt sợi dây đổng trên lửa đèn cồn.
D. Để sợi dây thép ngoài không khí ẩm bị gỉ.
Lời giải:
Đáp án đúng là: B
Quá trình biến đổi vật lí: Thắp sáng bóng đèn dây tóc.
Do quá trình này không có sự tạo thành chất mới.
Bài 2.3 trang 5 Sách bài tập KHTN 8: Cho hai quá trình sau:
(1) Đun nước đá nóng chảy thành nước lỏng.
(2) Nung thuốc tím rắn chuyển thành bột màu đen và có khí không màu thoát ra.
Kết luận đúng là:
A. (1) và (2) đều là biến đổi vật lí.
B. (1) và (2) đều là biến đổi hoá học.
C. (1) là biến đổi vật lí, (2) là biến đổi hoá học.
D. (1) là biến đổi hoá học, (2) là biến đổi vật lí.
Lời giải:
Đáp án đúng là: C
(1) là biến đổi vật lí do không có sự tạo thành chất mới.
(2) là biến đổi hoá học do có sự tạo thành chất mới.
Lời giải:
Các quá trình hoà tan, cô cạn thuộc loại biến đổi vật lí vì các chất chỉ thay đổi trạng thái tồn tại, không tạo ra chất mới. Sau khi hoàn thành chu trình lại trở về trạng thái ban đầu.
Lời giải:
Các giai đoạn chảy lỏng, hoá hơi của nến là biến đổi vật lí, ở đây nến chỉ chuyển trạng thái từ rắn sang lỏng, lỏng sang hơi, không tạo chất mới.
Giai đoạn hơi nến cháy là biến đổi hoá học, các chất mới là carbon dioxide và hơi nước được tạo thành.
A. không khí.
B. calcium oxide.
C. carbon dioxide.
D. calcium carbonate.
Lời giải:
Đáp án đúng là: D
Chất đầu của phản ứng là calcium carbonate.
A. ammonia.
B. nitrogen.
C. hydrogen.
D. iron.
Lời giải:
Đáp án đúng là: A
Sản phẩm của phản ứng là ammonia.
A. Số phân tử.
B. Số nguyên tử của mỗi nguyên tố.
C. Số chất (số chất phản ứng bằng số sản phẩm).
D. Tổng thể tích hỗn hợp phản ứng.
Lời giải:
Đáp án đúng là: B
Trong một phản ứng bất kì số nguyên tử của mỗi nguyên tố không thay đổi.
Bài 2.9 trang 6 Sách bài tập KHTN 8: a) Phản ứng hoá học là gì?
b) Chất nào gọi là chất phản ứng (hay chất đầu)? Chất nào là sản phẩm (hay chất cuối)?
c) Trong quá trình phản ứng, lượng chất đầu và chất cuối thay đổi thế nào?
Lời giải:
a) Phản ứng hoá học là quá trình biến đổi chất này thành chất khác.
b) Chất ban đầu bị biến đổi trong phản ứng được gọi là chất phản ứng (hay chất đầu); Chất mới sinh ra được gọi là sản phẩm (hay chất cuối).
c) Trong quá trình phản ứng, lượng chất phản ứng giảm dần, lượng sản phẩm tăng dần.
Lời giải:
- Câu hỏi 2.5 có phương trình chữ:
Paraffin + Oxygen → Carbon dioxide + Hơi nước.
- Câu hỏi 2.6 có phương trình chữ:
Calcium carbonate → Calcium oxide + Carbon dioxide.
- Câu hỏi 2.7 có phương trình chữ:
Nitrogen + Hydrogen → Ammonia.
Các từ thích hợp để điền vào vị trí (1), (2) lần lượt là:
A. cùng loại, cùng loại.
B. khác loại, khác loại.
C. khác loại, cùng loại.
D. cùng loại, khác loại.
Lời giải:
Đáp án đúng là: D
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, các liên kết giữa các nguyên tử (1) cùng loại bị phá vỡ, liên kết giữa các nguyên tử (2) khác loại được hình thành.
A. Chỉ có nước.
B. Oxygen và hydrogen.
C. Oxygen và nước.
D. Hydrogen và nước.
Lời giải:
Đáp án đúng là: A
Nước là sản phẩm phản ứng nên sau phản ứng lượng nước tăng lên.
A. Khí gas.
B. Khí hydrogen.
C. Than đá.
D. Dầu hoả.
Lời giải:
Đáp án đúng là: B
Khí hydrogen không phải là nhiên liệu dùng trong nhà bếp để đun nấu.
Lời giải:
Các chất phải tiếp xúc với nhau thì mới tạo liên kết mới giữa các nguyên tử.
Lời giải:
Do phân tử nước (H2O) có 2 nguyên tử hydrogen và 1 nguyên tử oxygen. Do đó, số phân tử hydrogen (H2) nhiều gấp đôi số phân tử oxygen (O2) đã phản ứng.
Ở nhiệt độ từ khoảng 500 °C, CaCO3 bắt đầu bị phân huỷ bởi nhiệt và quá trình phân huỷ xảy ra mạnh ở nhiệt độ khoảng từ 900 đến 1 000 °C.
CaCO3 CaO + CO2
Trong thực tế sản xuất, người ta thường để kích thước hạt của nguyên liệu khá lớn (60 - 150 mm). Do vậy, để phân huỷ hoàn toàn khối calcium carbonate cần nhiệt độ khá cao (900 - 1 400 °C).
Trong công nghiệp, lò được xây bằng gạch chịu lửa và sản xuất theo công nghệ nung liên tục. Lò nung vôi công nghiệp có ưu điểm là sản xuất vôi liên tục và không gây ô nhiễm không khí. Sau một thời gian nhất định, đá vôi và than được nạp lại vào lò, vôi sống được lấy ra qua cửa ở đáy lò, khí CO2 được thu qua cửa ở miệng lò và sử dụng sản xuất muối carbonate, nước đá khô.
a) Trong các quá trình sau đây, quá trình nào là biến đổi vật lí, quá trình nào là biến đổi hoá học?
(1) Đốt cháy củi, than đá, than cốc.
(2) Phân huỷ đá vôi ở nhiệt độ cao thành vôi sống.
(3) Vôi sống nóng để nguội.
(4) Khí carbon dioxide nóng bay lên và được thu ở cửa miệng lò theo đường ống dẫn.
(b) Phát biểu nào sau đây đúng?
A. Than đá cháy là phản ứng toả nhiệt; phân huỷ đá vôi là phản ứng thu nhiệt.
B. Than đá cháy là phản ứng thu nhiệt; phân huỷ đá vôi là phản ứng toả nhiệt.
C. Than đá cháy và phân huỷ đá vôi đều là phản ứng toả nhiệt.
D. Than đá cháy và phân huỷ đá vôi đều là phản ứng thu nhiệt.
c) Bạn An nói, để tiết kiệm nhiên liệu cần đóng kín các cửa lò, hạn chế nhiệt thất thoát ra ngoài. Ý kiến của bạn An có đúng không?
Lời giải:
a) Biến đổi hoá học: quá trình (1) và (2); biến đổi vật lí: quá trình (3) và (4).
b) Đáp án đúng là: A
Than đá cháy là phản ứng toả nhiệt; phân huỷ đá vôi là phản ứng thu nhiệt.
c) Sai. Đóng kín lò nung vôi thì sẽ ngăn không khí đưa oxygen vào lò để thực hiện phản ứng đốt cháy than. Do đó, phản ứng nung vôi sẽ không xảy ra.
Xem thêm các bài giải SBT Khoa học tự nhiên 8 Kết nối tri thức hay, chi tiết khác:
Bài 3: Mol và tỉ khối chất khí
Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Bài 6: Tính theo phương trình hóa học
Bài 7: Tốc độ phản ứng và chất xúc tác
Lý thuyết KHTN 8 Bài 2: Phản ứng hóa học
I. Biến đổi vật lí và biến đổi hoá học
- Thí nghiệm về sự chuyển thể của nước
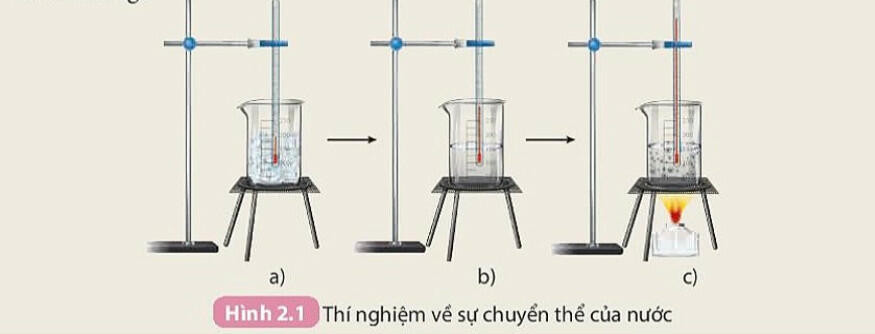
Hình 2.1 hướng dẫn cách thực hiện thí nghiệm về sự chuyển thể của nước bằng cách sử dụng nước đá viên, cốc thuỷ tinh 250mL, nhiệt kế, đèn cồn, kiếng sắt.
- Các quá trình như hoà tan, đông đặc, nóng chảy... chỉ là các quá trình chuyển đổi giữa các trạng thái của chất mà không tạo ra chất mới, đó là biến đổi vật lí.
Thí nghiệm về biến đổi hoá học:
- Chuẩn bị: bột sắt (Fe) và bột lưu huỳnh (S) theo tỉ lệ 7 : 4 về khối lượng; ống nghiệm chịu nhiệt, đèn cồn, đũa thuỷ tinh, thỏa thuỷ tinh.
- Tiến hành:
+ Trộn đều hỗn hợp bột sắt và bột lưu huỳnh. Lần lượt cho vào hai ống nghiệm (1) và (2) mỗi ống 3 thìa hỗn hợp.
+ Đưa nam châm lại gần ống nghiệm (1), quan sát hiện tượng.
+ Đun nóng mạnh đáy ống nghiệm (2) khoảng 30 giây rồi ngưng đun. Để nguội và đưa nam châm lại gần ống.
=> Các quá trình như đốt cháy nhiên liệu, phân huỷ chất (ví dụ: nung đá vôi,...), tổng hợp chất (ví dụ: quá trình quang hợp...) có sự tạo thành chất mới, đó là biến đổi hóa học. Trong cơ thể người và động vật, sự trao đổi chất là một loạt các quá trình sinh hoá, bao gồm cả biến đổi vật lí và biến đổi hoá học.
- Diễn biến phản ứng hoá học:
+ Trong phản ứng hoá học, xảy ra sự phá vỡ các liên kết trong phân tử chất đầu, hình thành các liên kết mới, tạo ra các phân tử mới. Kết quả là chất này biến đổi thành chất khác. Ví dụ: Phản ứng giữa hydrogen và oxygen tạo thành nước được mô tả như sau:
- Hiện tượng kèm theo các phản ứng hoá học:
+ Phản ứng hoá học xảy ra khi có chất mới được tạo thành với những tính chất mới, khác biệt với chất ban đầu. Những dấu hiệu dễ nhận ra có chất mới tạo thành là sự thay đổi về màu sắc, xuất hiện chất khí hoặc xuất hiện chất kết tủa...
+ Sự toả nhiệt và phát sáng cũng là dấu hiệu cho biết phản ứng hoá học đã xảy ra
+ Dấu hiệu nhận biết có chất mới tạo thành
III. Năng lượng của phản ứng hoá học
1. Phản ứng toả nhiệt, phản ứng thu nhiệt
- Phản ứng toả nhiệt giải phóng năng lượng (dạng nhiệt) ra môi trường xung quanh.
- Phản ứng thu nhiệt nhận năng lượng (dạng nhiệt) trong suốt quá trình phản ứng xảy ra.
2. Ứng dụng của phản ứng toả nhiệt
- Các phản ứng toả nhiệt có vai trò quan trọng trong cuộc sống vì chúng cung cấp năng lượng cho sinh hoạt và sản xuất, vận hành động cơ, thiết bị máy công nghiệp, phương tiện giao thông.