Với tóm tắt lý thuyết Hóa học lớp 11 Bài 4: Nitrogen sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 4: Nitrogen
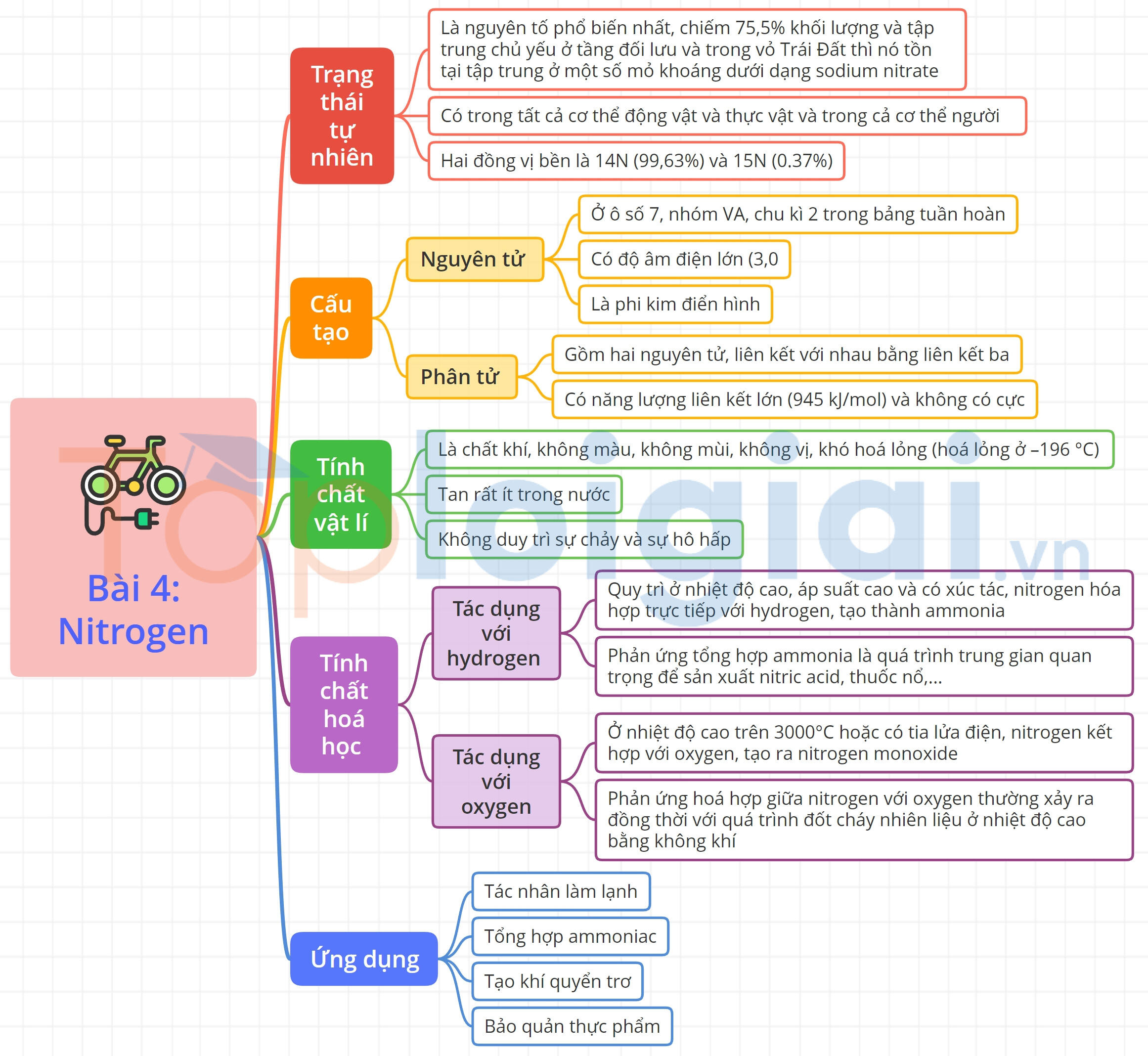
A. Lý thuyết Nitrogen
1. Trạng thái tự nhiên
Trong khí quyển Trái Đất, nitrogen là nguyên tố phổ biến nhất, chiếm 75,5% khối lượng (hoặc 78,1% thể tích ) và tập trung chủ yếu ở tầng đối lưu và trong vỏ Trái Đất thì nó tồn tại tập trung ở một số mỏ khoáng dưới dạng sodium nitrate.
Nguyên tố nitrogen có trong tất cả cơ thể động vật và thực vật và trong cả cơ thể người.
Nguyên tố nitrogen tồn tại trong tự nhiên với hai đồng vị bền là 14N (99,63%) và 15N (0.37%).
2. Cấu tạo nguyên tử, phân tử
a. Cấu tạo nguyên tử
Nguyên tố nitrogen ở ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn. Nguyên tử nitrogen có độ âm điện lớn (3,04). Nitrogen là phi kim điển hình.
b. Cấu tạo phân tử
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết Ϭ và 2 liên kết π). Phân tử nitrogen có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
3. Tính chất vật lí
Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hoá lỏng (hoá lỏng ở –196 °C), tan rất ít trong nước (1 lít nước hoà tan được 0,012 lit khí nitrogen). Khi nitrogen không duy trì sự chảy và sự hô hấp.
4. Tính chất hoá học
Nitrogen khá trơ ở nhiệt độ thường, ở nhiệt độ cao, nitrogen trở nên hoạt động hơn. Nitrogen thể hiện cả tính oxi hoá và tính khử.
a. Tác dụng với hydrogen
Quy trì Ở nhiệt độ cao, áp suất cao và có xúc tác, nitrogen hóa hợp trực tiếp với hydrogen, tạo thành ammonia.
Phản ứng tổng hợp ammonia là quá trình trung gian quan trọng để sản xuất nitric acid, thuốc nổ, đạm nitrate, urea, ammophos....
b. Tác dụng với oxygen
Ở nhiệt độ cao trên 3000°C hoặc có tia lửa điện, nitrogen kết hợp với oxygen, tạo ra nitrogen monoxide (NO)
N2(g) + O2(g) ⇌ 2NO(g) (điều kiện nhiệt độ)
Trong thực tế, phản ứng hoá hợp giữa nitrogen với oxygen thường xảy ra đồng thời với quá trình đốt cháy nhiên liệu ở nhiệt độ cao bằng không khi. Các hoạt động giao thông vận tải và sản xuất công nghiệp là nguyên nhân chính gây phát thải các oxide của nitrogen vào khí quyển.
5. Ứng dụng
- Tác nhân làm lạnh.
- Tổng hợp ammoniac.
- Tạo khí quyển trơ.
- Bảo quản thực phẩm.
Sơ đồ tư duy Nitrogen
B. Trắc nghiệm Nitrogen
Câu 1: Trong phản ứng: N2(g) + 3H2(g) 2NH3(g). N2 thể hiện
A. tính khử.
B. tính oxi hóa.
C. tính base.
D. tính acid.
Đáp án đúng là: B
Trong phân tử N2, nitrogen có số oxi hoá là 0. Trong hợp chất NH3, nitrogen có số oxi hoá là -3. Vậy số oxi hoá của nitrogen giảm trong phản ứng nên N2 thể hiện tính oxi hoá.
Câu 2: Trong phản ứng: N2(g) + O2(g)2NO(g). N2 thể hiện
A. tính khử.
B. tính oxi hóa.
C. tính base.
D. tính acid.
Đáp án đúng là: A
Trong phân tử N2, nitrogen có số oxi hoá là 0. Trong hợp chất NO, nitrogen có số oxi hoá là +2. Vậy số oxi hoá của nitrogen giảm trong phản ứng nên N2 thể hiện tính khử.
Câu 3: Ứng dụng nào sau đây không phải của N2?
A. Tổng hợp NH3.
B. Bảo quản máu.
C. Diệt khuẩn, khử trùng.
D. Bảo quản thực phẩm.
Đáp án đúng là: C
Ứng dụng của N2 là tổng hợp NH3, tác nhân làm lạnh, bảo quản máu, bảo quản thực phẩm, tạo khí quyển trơ.
Câu 4: Diêu tiêu Chile (hay diêm tiêu natri) là tên gọi khác của hợp chất nào sau đây?
A. Sodium chloride.
B. Potassium sulfate.
C. Sodium nitrate.
D. Potassium nitrate.
Đáp án đúng là: C
Diêu tiêu Chile (hay diêm tiêu natri) là tên gọi khác của hợp chất sodium nitrate.
Câu 5: Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do
A. nitrogen có bán kính nguyên tử nhỏ.
B. nitrogen có độ âm điện lớn.
C. phân tử nitrogen có liên kết ba bền vững.
D. phân tử nitrogen không phân cực.
Đáp án đúng là: C
Ở nhiệt độ thường, nitrogen khá trơ về mặt hoạt động hóa học là do phân tử nitrogen có liên kết ba bền vững.
Câu 6: Trong tự nhiên, đơn chất nitrogen có nhiều trong
A. nước biển.
B. không khí.
C. cơ thể người.
D. mỏ khoáng.
Đáp án đúng là: B
Trong khí quyển Trái Đất, nitrogen là nguyên tố phổ biến nhất, chiếm 75% khối lượng (hoặc 78,1% thể tích).
Câu 7: Đặc điểm cấu tạo của phân tử N2 là
A. có 1 liên kết ba.
B. có 1 liên kết đôi.
C. Có 2 liên kết đôi.
D. có 2 liên kết ba.
Đáp án đúng là: A
Phân tử nitrogen gồm hai nguyên tử, liên kết với nhau bằng liên kết ba (1 liên kết σ và 2 liên kết π).
Câu 8: Vị trí của nguyên tố N (Z = 7) trong bảng tuần hoàn các nguyên tố hóa học là
A. ô số 7, chu kì 3, nhóm VA.
B. ô số 3, chu kì 2, nhóm VIA.
C. ô số 7, chu kì 2, nhóm VIA.
D. ô số 7, chu kì 2, nhóm VA.
Đáp án đúng là: D
Nguyên tố nitrogen ở ô số 7, chu kì 2, nhóm VA trong bảng tuần hoàn.
Câu 9: Tính chất nào sau đây không phải tính chất vật lí của N2?
A. Chất khí.
B. Không màu.
C. Nặng hơn không khí.
D. Tan ít trong nước.
Đáp án đúng là: C
Ở điều kiện thường, nitrogen là chất khí, không màu, không mùi, không vị, khó hoá lỏng, tan rất ít trong nước, nhẹ hơn không khí vì .
Câu 10: Trong hợp chất, nitrogen có các mức oxi hóa nào sau đây?
A. -3, +3, +5.
B. -3, 0, +3, +5.
C. -3, +1, +2, +3, +4, +5.
D. -3, 0, +1, +2, +3, +4, +5.
Đáp án đúng là: C
Nitrogen tạo ra nhiều hợp chất với các số oxi hoá khác nhau từ -3 đến +5. Các số oxi thường gặp của nitrogen trong hợp chất là: -3, +1, +2, +3, +4, +5.
Câu 11: Trong phòng thí nghiệm, người ta thu khí nitrogen bằng phương pháp dời nước vì
A. N2 nhẹ hơn không khí.
B. N2 ít tan trong nước.
C. N2 không duy trì sự sống, sự cháy.
D. N2 hoá lỏng, hóa rắn ở nhiệt độ rất thấp.
Đáp án đúng là: B
Trong phòng thí nghiệm, người ta thu khí nitrogen bằng phương pháp dời nước vì N2 ít tan trong nước.
Câu 12: Trong các phản ứng, N2 vừa thể hiện tính oxi hóa, vừa thể hiện tính khử là do trong N2 nguyên tử N có
A. số oxi hóa trung gian.
B. số oxi hóa cao nhất.
C. số oxi hóa thấp nhất
D. hóa trị trung gian.
Đáp án đúng là: A
Trong các phản ứng, N2 vừa thể hiện tính oxi hóa, vừa thể hiện tính khử là do trong N2 nguyên tử N có số oxi hóa trung gian là 0.
Câu 13: Tìm các tính chất không thuộc về khí nitrogen?
(a) Hóa lỏng ở nhiệt độ rất thấp (-196oC)
(b) Cấu tạo phân tử nitrogen là
(c) Tan nhiều trong nước
(d) Nặng hơn khí oxygen
(e) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử.
A. (a), (c), (d).
B. (a), (b).
C. (c), (d), (e).
D. (b), (c), (e).
Đáp án đúng là: C
Ở điều kiện thường, nitrogen tan rất ít trong nước, nhẹ hơn khí oxygen (28 < 32), khí nitrogen khá trơ, rất bền.
Câu 14: Cho các phát biểu sau:
(a) Trong không khí, N2 chiếm khoảng 78% về thể tích.
(b) Phân tử N2 có chứa liên kết ba bền vững nên N2 trơ về mặt hóa học ngay cả khi đun nóng.
(c) Trong phản ứng giữa N2 và H2 thì N2 vừa là chất oxi hóa, vừa là chất khử.
(d) N2 lỏng có nhiệt độ thấp nên thường được sử dụng để bảo quản thực phẩm.
(e) Phần lớn N2 được sử dụng để tổng hợp NH3 từ đó sản xuất nitric acid, phân bón, ...
Số phát biểu đúng là
A. 2
B. 3.
C. 4.
D. 5.
Đáp án đúng là: A
(b) Sai vì N2 chỉ trơ về mặt hoá học ở nhiệt độ thường, khi đun nóng N2 trờ nên hoạt động hơn.
(c) Sai vì trong phản ứng giữa N2 và H2 thì N2 là chất oxi hoá, H2 là chất khử.
(d) Sai vì để bảo quản thực phẩm người ta sử dụng khí N2, N2 lỏng được sử dụng bảo quản máu và các mẫu sinh vật.
Câu 15: Cho cân bằng hoá học: N2(g) + 3H2(g) 2NH3(g). Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi áp suất của hệ.
B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ.
D. thêm chất xúc tác Fe.
Đáp án đúng là: D
Chất xúc tác không ảnh hưởng đến chuyển dịch cân bằng.
Xem thêm các bài tóm tắt Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 2: Cân bằng trong dung dịch nước
Lý thuyết Bài 5: Ammonia. Muối ammonium
Lý thuyết Bài 6: Một số hợp chất của nitrogen với oxygen
Lý thuyết Bài 7: Sulfur và sulfur dioxide