Tailieumoi.vn biên soạn và giới thiệu các kiến thức trọng tâm về Oxi (O) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Oxi, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Oxi (O): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Oxi là một phi kim.
- Kí hiệu: O – CTPT : O2
- Cấu hình electron: 1s22s22p4
- Số hiệu nguyên tử: Z = 8
- Khối lượng nguyên tử: 16
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 8, nhóm VIA
+ Chu kì: 2
- Đồng vị: Oxi có 3 đồng vị bền là 168O , 178O , 188O
- Độ âm điện: 3,44
- Oxi là chất khí không màu, không mùi, hơi nặng hơn không khí ( d = 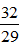
- Ở áp suất thường, oxi hóa lỏng ở -183oC
- Khí oxi ít tan trong nước.
Nhận xét: Oxi là một chất oxi hóa mạnh, tính phi kim chỉ thua mỗi flo, không thể hiện tính khử
O2 + 4e → 2O2-
1. Tác dụng với kim loại
Oxi oxi hóa được hầu hết kim loại trừ Ag, Au và Pt
2. Tác dụng với phi kim
Oxi tác dụng với nhiều phi kim, trừ halogen
3. Tác dụng với hợp chất
C2H5OH + 3O2 → 2CO2 + 3H2O
- Trong tự nhiên, oxi tồn tại ở cả dạng đơn chất và hợp chất.
- Ở dạng đơn chất, oxi có trong không khí, chiếm khoảng 20% thể tích không khí. Oxi trong không khí là sản phẩm của quá trình quang hợp của cây xanh. Nhờ sự quang hợp của cây xanh mà lượng khí oxi trong không khí hầu như không đổi.
6CO2 + 6H2O 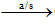
1. Trong phòng thí nghiệm
Nguyên tắc: Phân hủy các chất giàu O, kém bền nhiệt như H2O2, KMnO4, KClO3,...
2KMnO4 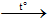
2KClO3 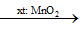
2H2O2 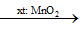
2. Trong công nghiệp
a. Từ không khí
* Phương pháp: chưng cất phân đoạn không khí lỏng
b. Từ nước
* Phương pháp: điện phân nước
2H2O 
- Là chất duy trì sự sống, sự cháy
- Là nguyên liệu, nhiên liệu cần thiết cho các hoạt động công nghiệp và sinh hoạt.
- ozon ( O3 ) và hiđro peoxit (H2O2 )
VIII. Bài tập liên quan về Oxi (O)
Câu 1: Vị trí của nguyên tố oxi (z = 8) trong bảng tuần hoàn hóa học là
A. Ô thứ 8, chu kì 3, nhóm VIA.
B. Ô thứ 8, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm VIA.
D. Ô thứ 16, chu kì 2, nhóm VIA.
Lời giải:
Đáp án B.
Cấu hình electron của oxi: 1s22s22p4
Oxi thuộc ô thứ 8 (do z = 8), chu kỳ 2 (do có 2 lớp e), nhóm VIA (do có 6e hóa trị, nguyên tố p).
Câu 2: Nguyên tử oxi có cấu hình electron là 1s22s22p4. Cấu hình electron của ion oxit O2- là
A. 1s22s22p2. B. 1s22s22p63s2.
C. 1s22s22p6. D. 1s22s22p43s2.
Lời giải:
Đáp án C.
O + 2e → O2-
→ Cấu hình electron của O2- là: 1s22s22p6.
Câu 3: Để phân biệt khí oxi và ozon, có thể dùng hóa chất là
A. hồ tinh bột.
B. dung dịch KOH và hồ tinh bột.
C. khí hiđro.
D. dung dịch KI và hồ tinh bột.
Lời giải:
Đáp án D.
2KI + O3 + H2O → I2 ↓ + 2KOH + O2 ↑
I2 làm xanh hồ tinh bột.
Câu 4: Oxi không tác dụng với kim loại nào sau đây?
A. Mg. B. Al.
C. Fe. D. Au.
Lời giải:
Đáp án D.
Oxi phản ứng với hầu hết các kim loại trừ Au, Pt ...
2Mg + O2 → 2MgO
4Al + 3O2 → 2Al2O3
3Fe + 2O2 → Fe3O4
Câu 5: Giữa cặp chất nào sau không xảy ra phản ứng hóa học?
A. NH3 và HCl. B. H2S và Cl2.
C. Cl2 và O2. D. H2S và O2.
Lời giải:
Đáp án C.
NH3 + HCl → NH4Cl
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
2H2S + O2 → 2S↓ + 2H2O
Cl2 không phản ứng trực tiếp với O2.
Câu 6: Hợp chất nào sau đây không phản ứng với O2?
A. SO3. B. CH4.
C. CO. D. SO2.
Lời giải:
Đáp án A.
CH4 + 2O2 → CO2 + 2H2O
2CO + O2 → 2CO2
2SO2 + O2 ⇆ 2SO3
Câu 7: Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một số mol các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. từ KMnO4 là lớn nhất
B. từ KClO3 là lớn nhất
C. từ H2O2 là lớn nhất
D. bằng nhau
Lời giải:
Đáp án B.
Phương trình hóa học:
Câu 8: Nhiệt phân hoàn toàn 3,16 gam KMnO4, thu được V lít O2 (đktc). Giá trị của V là
A. 0,224 B. 1,120
C. 4,480 D. 2,240
Lời giải:
Đáp án A.
Câu 9: Hãy chọn phát biểu đúng về oxi và ozon?
A. Oxi và ozon đều có tính oxi hoá mạnh như nhau.
B. Oxi và ozon đều có số proton và số notron giống nhau trong phân tử.
C. Oxi và ozon là các dạng thù hình của nguyên tố oxi.
D. Oxi và ozon đều phản ứng được với các chất như: Ag, KI, PbS ở nhiệt độ thường.
Lời giải:
Đáp án C.
Oxi và ozon là các dạng thù hình của nguyên tố oxi.
Câu 10: Oxi hóa hoàn toàn m gam kim loại X cần vừa đủ 0,25m gam khí O2. Kim loại X là
A. Al B. Fe
C. Cu D. Ca
Lời giải:
Đáp án C
Chọn m = 32 gam ⇒ nO2 = 0,25 mol
Bảo toàn electron ⇒ nX.n = 0,25.4 ⇒ X = 32n ⇒ n = 2; X = 64 (Cu)