Tailieumoi.vn biên soạn và giới thiệu các kiến thức trọng tâm về Cacbon (C) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Cacbon, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Cacbon (C): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Cacbon là một phi kim
- Kí hiệu: C
- Cấu hình electron: 1s22s22p2
- Số hiệu nguyên tử: Z = 6
- Khối lượng nguyên tử: 12
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 6, nhóm IVA
+ Chu kì: 2
- Đồng vị: Cacbon có 2 đồng vị bền là 126C và 136C
- Độ âm điện: 2,55
- Nguyên tố C có nhiều dạng thù hình như: kim cương, than chì, fluleren
| Kim cương | Than chì | Fluleren |
|
- Là chất rắn trong suốt, không màu, lấp lánh rất đẹp - Rất bền, cứng nhất, nhiệt độ nóng chảy rất cao (3750oC) - Không dẫn điện, dẫn nhiệt kém |
- là chất rắn màu xám đen, có ánh kim, dẫn điện, dẫn nhiệt tốt - Nhiệt độ nóng chảy cao, bền - Mềm, nhờn, trơn |
- Có rất nhiều nguyên tử C VD: C60, C70,... - Có dạng khối cầu rỗng, hình trụ,… |
- Than gỗ, than xương, than muội, than cốc là than nhân tạo, cacbon vô định hình, là một dạng đặc biệt của than chì.
- Than đỗ, than xương: xốp, nhẹ vì có các lỗ nhỏ li ti, có khả năng hấp phụ khí, chất tan trong dung dịch → than hoạt tính: lọc nước, khí,…
Nhận xét:
- Độ hoạt động hóa học: kim cương < than chì < cacbon vô định hình
- C là chất vừa có tính khử, vừa có tính oxi hóa
1. Tính khử
a. Khử oxi
Cacbon khử oxi khi đun nóng:
Ở nhiệt độ cao:
b. Khử oxit kim loại
- C khử oxit kim loại yếu, trung bình (ZnO → CuO)
2ZnO + C 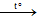
2CuO + C 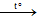
- C khử được một số oxit kim loại mạnh
CaO + 3C 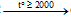
c. Khử nước
C + H2O 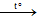
CO2 + C 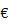
d. Khử một số hợp chất có tính oxi hóa mạnh
- Trong tự nhiên, nguyên tố C có ở dạng
+ Đơn chất: kim cương, than chì (graphit)
+ Hợp chất: cơ thể sống, vỏ trái đất (đá vôi - CaCO3 , đolomit - CaCO3.MgCO3 , dầu mỏ, khí đốt – các hiđrocacbon ),…
CH4 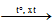
Gỗ 
| Kim cương |
- làm đồ trang sức - làm đầu mũi khoan, dao cắt kính,… |
| Than chì |
- làm điện cực, làm chén nung - làm ruột bút chì đen, chất phụ gia trong dầu mỡ bôi trơn |
| Than muội | - làm mực in, chất tạo màu đen và chất độn cho cao su, chất dẻo,… |
| Than cốc | - làm chất khử điều chế kim loại |
| Than gỗ, than xương |
- làm than hoạt tính: lọc khí, lọc nước - làm chất khử điều chế kim loại, làm nhiên liệu,… |
- Cacbon monooxit (CO)
- Cacbon đioxit ( CO2)
- H2CO3 , muối cacbonat.
VIII. Bài tập liên quan về Cacbon (C)
Phương pháp:
- Các oxit của kim loại (đứng sau Al) bị khử bởi CO (hoặc C) → Kim loại + CO2
- Bảo toàn nguyên tố: CO + O(oxit) → CO2
C + 2O(oxit) → CO2
Ta có: nO( oxit) = nCO = nCO2
nC = nCO2 = 2nO (oxit)
- Sử dụng bảo toàn khối lượng để giải toán
Ví dụ 1 : Khử 32g Fe2O3 bằng CO dư, sản phẩm thu được cho vào bình đựng nước vôi trong dư thu được a gam kết tủa. Gía trị của a là:
A. 20g B. 40g C. 60g D. 80g
Hướng dẫn giải:
nFe2O3 = 0,2 mol
CO + O(oxit) → CO2
Ta có: nCO2 = nO ( oxit) = 3nFe2O3 = 0,6 mol
nCaCO3 = nCO2 = 0,6 mol
m↓ = mCaCO3 = a = 0,6.100 = 60g ⇒ Đáp án C
Ví dụ 2 : Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng.
A. Fe2O3; 65%. B. Fe3O4; 75%.
C. FeO; 75%. D. Fe2O3; 75%
Hướng dẫn giải:
nCO = 0,2 mol
Hỗn hợp khí có M = 2.20 = 40 ⇒ Khí thu được gồm CO và CO2, oxit sắt hết
Bảo toàn C: nkhí sau = n CO2 + n CO dư = n CO bđ = 0,2 mol
Sử dụng sơ đồ đường chéo ⇒ nCO2 = 0,15mol; nCO dư = 0,05 mol
%VCO2 = 0,15/0,2.100% = 75%
nO(oxit) = n CO2 = 0,15 mol
m Fe (oxit) = m oxit – m O = 8 – 0,15.16 = 5,6g ⇒ nFe = 0,1 mol
nFe : nO = 0,1 : 0,15 = 2 : 3 ⇒ oxit sắt là: Fe2O3
⇒ Đáp án D
Phương pháp:
OH- + CO2 → CO32- + H2O (1)
OH- + CO2 → HCO3- (2)
Lập tỉ số:
Nếu: K ≥ 2: Chỉ tạo muối cacbonat (CO32-), chỉ xảy ta phản ứng (1)
K≤ 1: Chỉ tạo axit (HCO3-), chỉ xảy ra phản ứng (2)
1< K < 2: tạo ra hỗn hợp muối (HCO3- và CO32-) xảy ra cả 2 phản ứng (1) và (2)
Với dạng bài này thường sử dụng đồ thị để biểu diễn mỗi quan hệ giữa số mol kết tủa hoặc số mol OH- với số mol CO2
Lưu ý: Với những bài toàn không tính được K, ta phải dựa vào dữ kiện đề bài để tìm ra khả năng tạo muối như:
+ Hấp thu CO2 vào chỉ dung dịch bazơ dư⇒ chỉ tạo muối CO32-
+ Hấp thu CO2 dư vào chỉ dung dịch bazơ ⇒ chỉ tạo muối HCO3-
+ Nếu dung dịch sau phản ứng thêm OH- vào lại sinh ra CO32- ( hoặc đun nóng ) ⇒ Trong dung dịch có HCO3-:
HCO3- + OH- → CO32-
2HCO3- t℃ → CO32- + CO2 + H2O
+ Nếu bài toán không cho bất kì dữ liệu nào thì phải chia trường hợp để giải
Ví dụ 1 : Hấp thụ hoàn toàn 4,48l khí CO2 ở (đktc) vào 500ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Gía trị của m là:
A. 19,70 B. 17,73 C. 9,85 D. 11,82
Hướng dẫn giải:
nCO2 = 0,2 mol; nOH- = n NaOH + 2nBa(OH)2 = 0,25 mol
1< nOH- : nCO2 < 2 ⇒ Tạo hỗn hợp muối CO32- và HCO3-
CO2 + OH- → HCO3- (1)
x x x (mol)
CO2 + 2OH- → CO32- (2)
y 2y y (mol)
nCO2 = x + y = 0,2
nOH- = x + 2y = 0,25
⇒ x = 0,15; y = 0,05
Ba2+ + CO32- → BaCO3
0,1 0,05 (mol)
⇒ Ba2+ dư
⇒ n BaCO3 = n CO32- = 0,05⇒ m = 0,05 .197 = 9,85g
⇒ Đáp án C
Ví dụ 2 : Sục a mol khí CO2 vào dung dịch Ca(OH)2 thu được 3g kết tủa. Lọc tách kết tủa rồi đun nóng nước lọc lại thu được thêm 2g kết tủa nữa. Gía trị của a là:
A. 0,05 mol B. 0,06 mol C. 0,07 mol D. 0,08 mol
Hướng dẫn giải:
nCaCO3 lúc đầu = 0,03 mol
Đun thêm nước lọc lại thu được kết tủa ⇒ trong dung dịch có muối HCO3-
nCaCO3 thêm = n CO32- = 0,02
2HCO3- t℃ → CO32- + CO2 + H2O
0,04 ← 0,02 ( mol)
Bảo toàn C: nCO2 = nCaCO3 lúc đầu + nHCO3- = 0,03 + 0,04 = 0,07 mol
⇒ Đáp án C
Ví dụ 3 : Sục CO2 vào dũng dịch hỗn hợp gồm Ca(OH)2 và KOH ta quan sát hiện tượng theo đồ thị hình bên (số liệu được tính theo đơn vị mol). Giá trị của x là?
A. 0,10 B. 0,11 C. 0,13 D.0,12
Hướng dẫn giải:
Quan sát đồ thị ta thấy số mol CO2 = 0,15 thì kết tủa max
⇒ nCa(OH)2 = nCaCO3 max = 0,15 mol
nCO2 hòa tan kết tủa = 0,5 – 0,45 = 0,05 mol
CO2 + H2O + CaCO3 → Ca(HCO3)2
0,05 → 0,05 (mol)
⇒ nCaCO3 bị hòa tan = 0,05 mol
⇒ nCaCO3 còn lại = x = 0,15 – 0,05 = 0,1 mol
⇒ Đáp án A
Phương pháp:
- Khi cho từ từ HCl vào hỗn hợp muối cacbonat và hiđrocacbonat phản ứng xảy ra theo trình tự:
Đầu tiên: H+ + CO32- → HCO3-
Sau đó: H+ + HCO3- → CO2 + H2O
- Khi cho từ từ hỗn hợp muối cacbonat và hiđrocacbonat vào dung dịch HCl, xảy ra đồng thời theo đúng tỉ lệ của 2 muối để tạo khí CO2
- Khi đổ nhanh dung dịch H+ vào hỗn hợp muối cacbonat và hiđrocacbonat, H+ bị thiếu thì ta chỉ tính được khoảng thể tích khí H2 thoát ra, không tính được chính xác. Tìm khoảng thể tích bằng cách xét trường hợp:
+ TH1: H+ + CO32- trước, HCO3- sau ⇒ Thu được V1 lít CO2
+ TH2: H+ + HCO3- trước, CO32- sau⇒ Thu được V2 lít CO2
⇒ V1 < VCO2 < V2
Ví dụ 1 : Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chưa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
A. 0,03 B. 0,01 C. 0,02 D.0,015
Hướng dẫn giải:
nHCl = 0,03 mol; nNa2CO3 = 0,02 mol; nNaHCO3 = 0,02 mol
Khi cho từ từ HCl vào dung dịch xảy ra phản ứng theo thứ tự:
H+ + CO32- → HCO3-
0,02 0,02 0,02 (mol)
nH+ còn = 0,01 mol; nHCO32- = 0,02 + 0,02 = 0,04 mol
H+ + HCO3- → CO2 + H2O
0,01 0,04
⇒ nCO2 = nH+ = 0,01 mol
⇒ Đáp án B
Ví dụ 2 : Nhỏ từ từ 200ml dung dịch X (K2CO3 1M và NaHCO3 0,5M) vào 200ml dung dịch HCl 2M thì thể tích khí CO2 thu được là:
A. 4,48l B. 5,376l C. 8,96l D. 4,48l
Hướng dẫn giải:
nCO32- = 0,2 mol; n HCO3- = 0,1 mol; n H+ = 0,4 mol
n CO32- : n HCO3- = 2:1
⇒ 5H+ + 2CO32- + HCO3- → 3CO2 + 3H2O
0,4 0,2 0,1
⇒ H+ hết; n CO2 = 3/5 nH+ = 0,24 ⇒ V CO2 = 5,376 lít
⇒ Đáp án B
Ví dụ 3 : Cho đồng thời 1 lít dung dịch HCl 2M, vào 1 lít dung dịch hỗn hợp Na2CO3 1M và NaHCO3 1M. Đến khi phản ứng hoàn toàn thu được V lít khí (đktc). Gía trị của V là:
A. 33,6 B. 22,4 ≤ V ≤ 33,6 C. 33,6 D. Kết quả khác
Hướng dẫn giải:
nH+ = 2 mol; nNa2CO3 = 1 mol; nNaHCO3 = 1 mol
TH1: H+ phản ứng với Na2CO3 trước
2H+ + CO32- → CO2 + H2O
2 ← 1 → 1
(mol)
H+ phản ứng vừa đủ với CO32- ⇒ VCO2 = 1.22,4 = 22,4 lít
TH2: H+ phản ứng với HCO3- trước
H+ + HCO3- → CO2 + H2O
1 ← 1 → 1 (mol)
⇒ H+ dư = 1 mol
2H+ + CO32- → CO2 + H2O
1 → 0,5 → 0,5 (mol)
⇒ VCO2 = (0,5 + 1).22,4 = 33,6 lít
⇒ 22,4 ≤ V ≤ 33,6 ⇒ Đáp án B
Phương pháp:
Phản ứng nhiệt phân:
2HCO3- to→ CO32- + CO2 + H2O
M(CO3)2 to→ MO + CO2
Chú ý: Muối cacbonat của kim loại kiềm không bị nhiệt phân hủy
Ví dụ 1 : Nung nóng 100g hỗn hợp NaHCO3 và Na2CO3 đến khối lượng không đổi thu được 69kg hỗn hợp rắn. % khối lượng của NaHCO3 trong hỗn hợp là:
A. 80% B. 70% C. 80,66% D. 84%
Hướng dẫn giải:
2NaHCO3 to→ Na2CO3 + CO2 + H2O
x 0,5x 0,5x (mol)
mc/r giảm = mCO2 + mH2O = 31x = 100 – 69 = 31 => x = 1 mol
%mNaHCO3 = 1.84/100.100% = 84%
⇒ Đáp án D
Ví dụ 2 : X là một loại đá vôi chứa 80% CaCO3 phần còn lại là tạp chất trơ. Nung 50g X một thời gian thu được 39g chất rắn. %CaCO3 bị phân hủy là:
A. 50,5% B. 60% C. 62,5% D. 65%
Hướng dẫn giải:
mCaCO3 = 50.80% = 40g
Áp dụng định luật bảo toàn khối lượng:
m c/rắn giảm = m CO2 = 11g
CaCO3 to→ CaO + CO2
100g 44g
11.100/44 = 25g ← 11g
⇒%mCaCO3 bị thủy phân = 25/40.100% = 62,5%
⇒ Đáp án C
Phương pháp:
+ Si + 2NaOH + H2O → Na2SiO3 + 2H2
+ SiO2 + 2NaOH to→ Na2SiO3 + H2O
+ SiO2 + Na2CO3 to→ Na2SiO3 + H2O
+ SiO2 + 4HF → SiF4 + 2H2O ⇒ Không đựng axit HF trong bình thủy tinh
H2SiO3 < H2CO3
Ví dụ 1 : Đun nóng 2,5 gam hỗn hợp gồm silic và cacbon với dung dịch kiềm đặc, nóng thu được 1,4 lít H2(đktc). Thành phần % theo khối lượng của cacbon trong hỗn hợp là :
A. 30,0%. B. 65,0%. C. 70,0%. D. 35,0%.
Hướng dẫn giải:
nH2 = 0,0625 mol
Si + 2NaOH + H2O → Na2SiO3 + 2H2
0,03125 ← 0,0625 (mol)
%mSi = 0,03125.28/2,5.100% = 35%
⇒ % mC = 100% - 35% = 65%
⇒ Đáp án B
Ví dụ 2 : Một loại thủy tinh thường chứa 9,62% Na; 8,37% Ca; 35,15% Si còn lại là oxi. Thành phần của thủy tinh dưới dạng oxit là:
A. Na2O.CaO.5SiO2 B. Na2O.2CaO.5SiO2
C. 2Na2O.CaO.14SiO2 C. Na2O.CaO.6SiO2
Hướng dẫn giải:
Gọi công thức của thủy tinh là: xNa2O.yCaO.zSiO2
nNa : n Ca : n Si = 2x : y : z = (%mNa)/23 = (%mCa)/40= (%mSi)/28 = 2 : 1 : 6
⇒ x : y : z = 1 : 1 : 6
⇒ Đáp án C
Ví dụ 3 : Nung nóng hỗn hợp gồm 3 gam Mg và 3g SiO2, sau đó cho hỗn hợp sau phản ứng tác dụng với NaOH đặc, giả sử hiệu suất đạt 100%. Thể tích khí (đktc) thu được là:
A. 1,12 lít B. 2,24 lít C. 2,8 lít D. 0,56 lít
Hướng dẫn giải:
nMg = 0,125 mol; nSiO2 = 0,05 mol
2Mg + SiO2 → 2MgO + Si
0,1 ← 0,05 → 0,05 (mol)
⇒ Mg dư
Si + 2NaOH+ H2O → Na2SiO3 + 2H2
0,05 → 0,1 (mol)
Vkhí = 0,1.22,4 = 2,24 lít
⇒ Đáp án B