Tailieumoi.vn biên soạn và giới thiệu các kiến thức trọng tâm về Nitơ (N) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Nitơ, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Nitơ (N): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Nitơ là một phi kim
- Kí hiệu: N → CTPT: N2
- Cấu hình electron: 1s22s22p3
- Số hiệu nguyên tử: Z = 7
- Khối lượng nguyên tử: 14
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 7, nhóm VA
+ Chu kì: 2
- Đồng vị: nitơ có 2 đồng vị bền là 147N và 157N
- Độ âm điện: 3,04
- Ở điều kiện bình thường, nitơ là chất khí không màu, không mùi, không vị, chiếm khoảng 80% V không khí.
- Nitơ tan rất ít trong nước (đơn giản coi không tan trong nước).
- Khí nitơ không duy trì sự sống và sự cháy.
- Nhiệt độ sôi: -196oC
Nhận xét:
- Ở điều kiện thường, nitơ kém hoạt động hóa học vì có liên kết ba bền. Ở nhiệt độ cao, liên kết ba đẽ đứt hơn nên nitơ hd hóa học hơn.
- Nitơ vừa có tính oxi hóa, vừa có tính khử
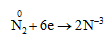
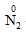
1. Tính oxi hóa
a. Tác dụng với hiđro
b. Tác dụng với kim loại hoạt động
- Nitơ oxi hóa liti (Li) ở nhiệt độ thường:
- Nitơ chỉ oxi hóa các kim loại hoạt động khi đốt nóng:
2. Tính khử
1. Trong phòng thí nghiệm
NH4NO2 (dung dịch bão hòa) 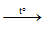
Có thể thay: Đun nóng dung dịch bão hòa của NH4Cl + NaNO2
NH4Cl + NaNO2 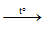
2. Trong công nghiệp
* Phương pháp: chưng cất phân đoạn không khí lỏng
- Sản xuất khí amoniac ( NH3)
- Dùng nitơ lỏng để bảo quản máu, xác,…
- Dùng khí nitơ để bảo quản thực phẩm, chữa bệnh,…
- Amoniac (NH3 ), muối amoni
- Các oxit của nitơ
- Axit nitric (HNO3 ), muối nitrat (NO3- )
VII. Bài tập liên quan về Nitơ (N)
Phương pháp:
N2 + 3H2 ⇔ 2NH3
+ Tính số mol các chất để xác định hiệu suất tính theo chất nào, nếu bài toán không cho ta tự đặt lượng mol cho các chất đúng với tỉ lệ đề bài cho.
+ Sử dụng bảo toàn khối lượng để xác định số mol trước và sau phản ứng.
Ví dụ 1 : Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là:
A. 50%. B. 40%. C. 25%. D. 36%.
Hướng dẫn giải:
Sử dụng sơ đồ đường chéo ⇒ nN2 : nH2 = 1: 4
Gỉa sử nN2 = 1 mol; nH2 = 4 mol
N2 + 3H2 ⇔ 2NH3
Ban đầu: 1 4 (mol)
Phản ứng: x 3x 2x (mol)
Sau pư: 1-x 4-3x 2x (mol)
Hiệu suất tính theo N2; nsau pư = nH2 + nN2 + nNH3 = 5 – 2x (mol)
Áp dụng định luật bảo toàn khối lượng:
mtrước = msau
nt = 5mol ⇒ ns = 4,5 mol = 5- 2x
⇒ x = 0,25 mol
⇒ H% = x/1.100% = 25% ⇒ Đáp án C
Ví dụ 2 : Cho a mol N2 phản ứng với 3a mol H2, sau phản ứng áp suất của hệ giảm 10%. Hiệu suất phản ứng tổng hợp NH3 là:
A. 30% B. 25% C. 20% D. 40%
Hướng dẫn giải:
N2 + 3H2 ⇔ 2NH3
Ban đầu: a 3a (mol)
Hiệu suất tính theo N2 hoặc H2 là như nhau ( do tỉ lệ mol của N2 và H2 = 2 :3)
Áp suất giảm chính là số mol khí giảm
Theo phương trình: ngiảm = 2 nN2 pư = 10% .4a = 0,4a
⇒ nN2 pư = 0,2a
H% = 0,2a/a.100% = 20% ⇒ Đáp án C
Phương pháp:
+ Đặt công thức phân tử NxOy
+ Sử dụng các dữ kiện để xác định x, y (1≤ x ≤2; 1≤ y ≤ 5; x,y nguyên )
Ví dụ 1 : Mỗt hỗn hợp khí X gồm 3 oxit của N là NO, NO2 và NxOy. Biết phần trăm thể tích của các oxit trong X là: %VNO = 45%, %VNO2 = 15%, %VNxOy = 40%, còn phần trăm theo khối lượng NO trong hỗn hợp là 23,6%. Công thức NxOy là:
A. N2O B. NO B. NO2 D. N2O4
Hướng dẫn giải:
Cùng điều kiện tỉ lệ V là tỉ lệ n. Gọi nX = a
⇒ nNO = 0,45a mol; nNO2 = 0,15a mol; nNxOy = 0,4a mol.
mNO = 30 × 0,45a = 13,5a (g) ⇒ mX = 13,5a : 23,6% = 57,2a (g)
⇒mNxOy = mhhX – mNO – mNO2 = 57,2a – 13,5a – 6,9a = 36,8a
MNxOy = 36,8a : 0,4a = 92
Vậy oxit NxOy là N2O4 ⇒ Đáp án D
Ví dụ 2 : Một hỗn hợp X gồm CO2 và một oxit của nitơ có tỉ khối đối với H2 là 18,5. Công thức oxit của nitơ và % thể tích CO2 trong hỗn hợp X là:
A. NO; 40% B. NO; 50% C. N2O; 40% D. N2O; 50%
Hướng dẫn giải:
MX = 18,5.2 = 37
⇒ MNxOy < 37.
⇒14x + 16y < 37. x, y phải nguyên dương ⇒x = 1, y = 1.
Vậy oxit của nitơ là NO.
Giả sử trong 1mol hỗn hợp X có a(mol) CO2 và (1-a)mol NO.
Ta có: 44a + 30(1 – a) = 37 ⇒ a = 0,5
⇒ %VCO2 = %VNO = 50%
⇒ Đáp án B
Phương pháp:
+ HNO3 có N5+ ⇒ Có oxi hóa mạnh khi tác dụng với các chất có tính khử như: Kim loại, phi kim, các hợp chất Fe(II), hợp chất S2-, I-. Và sản phẩm khử gồm các khí như: N2O, N2, NO, NO2 hoặc muối amoni (NH4+)
+ Sử dụng phương pháp bảo toàn e để giải toán
Chú ý:
+ Al, Cr, Fe bị thụ động ( không phản ứng) với trong axit HNO3 đặc, nguội
+ Một số bài toán ta phải chú ý biện luận trường hợp tạo ra các sản phẩm khử
+ Khi axit HNO3 tác bazơ, oxit bazơ không có tính khử chỉ xảy ra phản ứng trung hòa
+ Kim loại có nhiều hóa trị (như Fe, Cr), nếu dùng dư axit sẽ tạo muối hóa trị 3 của kim loại (Fe3+, Cr3+); nếu axit dùng thiếu, dư kim loại sẽ tạo muối hóa trị 2 (Fe2+, Cr2+), hoặc có thể tạo đồng thời 2 loại muối.
Ví dụ 1 : Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch X và 2,24 lit khí NO (đktc). X tác dụng vừa đủ với 300 ml dung dịch NaOH 2 M được kết tủa Y. Sau khi nung Y đến khối lượng không đổi thu được 20 g chất rắn. Khối lượng Cu ban đầu và nồng độ % dung dịch HNO3 ban đầu:
Hướng dẫn giải:
nNO = 0,1 mol; nNaOH = 0,3.0,2 = 0,06 mol
Y + NaOH → kết tủa Y chỉ chứa Cu(OH)2 toC CuO
nCuO = 20:80 = 0,25 mol
Theo định luật bảo toàn nguyên tố:
nCu (ban đầu) = nCu (trong CuO) = nCu2+ = 0,25 mol
⇒ mCu = 0,25.64 = 16g
Cu → Cu2+ + 2e
0,25 → 0,5 (mol)
Mà: N+5 + 3e → N2+
0,3 ← 0,1 (mol)
0,1 < 0,5 ⇒ phản ứng của Cu và HNO3 phải tạo ra NH4NO3.
ne N5+ → N3- = 0,5 – 0,3 = 0,2 mol
N5+ + 8e → N3-
0,2 → 0,025 (mol) ⇒ nNH4NO3 = 0,025 mol
nOH- = 2nCu2+ + nNH4+ nH+dư = 0,6 mol
⇒ nH+ dư = 0,6 – (2.0,25 + 0,025)= 0,075 (mol)
Bảo toàn nguyên tố N:
nHNO3 = 2nCu(NO3)2 + 2nNH4NO3 + nNO + nHNO3 dư = 0,725 mol
C%HNO3 = 0,725.63/800.100% = 5,71%
Ví dụ 2 : Hòa tan hết 20,4g hỗn hợp X gồm FeS, Fe3O4 trong dung dịch HNO3, kết thúc phản ứng thu được dung dịch Y và 4,48 lít hỗn hợp hai khí NO, N2 có tỉ khối so với H2 là 14,75. Phần trăm khối lượng FeS, Fe3O4 trong X lần lượt là:
A. 43,14% và 56,86% B. 56,86% và 43,14%
C. 5,6% và 94,4% D. 94,4% và 5,6%
Hướng dẫn giải:
Sử dụng sơ đồ đường chéo ⇒ nNO = 0,15 mol; nN2 = 0,05 mol
Gọi nFeS = x mol; nFe3O4 = y ⇒ 88x + 232y = 20,4 (1)
Cho e:
FeSo → Fe3+ + S6+ + 9e
x 9x (mol)
3Fe+8/3 → 3Fe3+ + e
3y y (mol)
Nhận e:
N5+ + 3e → N2+
0,45 ← 0,15 (mol)
2N5+ + 10e → N2o
0,5 ← 0,05 (mol)
Bảo toàn e: 9x + y = 0,45 + 0,5 = 0,95 (mol) (2)
Từ (1)(2) ⇒ x = 0,1; y = 0,05
%mFeS = 88.0,1/20,4.100% = 43,14%; %mFe3O4 = 56,86%
⇒ Đáp án A
Phương pháp:
Các chất khử phản ứng với muối NO3- trong môi trường axit tương tự phản ứng với HNO3. Ta cần quan tâm bản chất phản ứng là phương trình ion.
Ví dụ 1 : Hoà tan 0,1 mol Cu vào 120ml dung dịch X gồm HNO3 1M và H2SO4 0,5M. Sau khi phản ứng kết thúc thu được V lit khí NO duy nhất. Giá trị của V:
A. 1,344 lit B. 1,49 lit C. 0,672 lit D. 1,12 lit
Hướng dẫn giải:
nNO3- = 0,12; nH+ = 0,12 + 2. 0,06 = 0,24 mol
3Cu + 2NO3-+ 8H+ → 3Cu2+ + 2NO + 4H2O
0,1 0,12 0,24 (mol)
⇒ H+ phản ứng hết
nNO = 1/4 nH+ = 0,06 mol ⇒ V = 0,06.22,4 = 1,344 lít
⇒ Đáp án A
Ví dụ 2 : Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 ml B. 240 ml C. 400 ml D. 120 ml
Hướng dẫn giải:
nFe = 0,02 mol ; nCu = 0,03 mol
⇒ Σ ne cho = 0,02.3 + 0,03.2 = 0,12 mol
nH+ = 0,4 mol ; nNO3- = 0,08 mol
NO3- + 3e + 4H+ → NO + 2H2O
0,12→ 0,16 (mol)
⇒nH+ dư = 0,4 – 0,16 = 0,24 mol
⇒ Σ nOH- (↓max) = nH+ + 3nFe3+ + 2nCu2+ = 0,24 + 0,02.3 + 0,03.2 = 0,36
⇒ V = 0,36 lít = 360 ml⇒Đáp án A
Phương pháp:
+ Muối nitrat của kim loại đứng trước Mg → muối nitrit + O2
+ Muối nitrat của kim loại từ Mg đến Cu → Oxit kim loại + NO2 + O2
+ Muối nitrat của kim loại đứng sau Cu → Kim loại + NO2 + O2
+ Muối NH4NO3 → N2O + 2H2O
Chú ý: mc/r giảm = mkhí
Ví dụ 1 : Nhiệt phân hoàn toàn m gam hỗn hợp X gồm KNO3 và Mg(NO3)2 thu được 16,5 gam chất rắn và 12,32 lít khí ( đktc). Phần trăm khối lượng của KNO3 và giá trị của m là:
A. 74,56% và 39,7g B. 25,44% và 34,1g
C. 25,44% và 39,7g D. 74,56% và 39,7g
Hướng dẫn giải:
Gọi nKNO3 = x mol; nMg(NO3)2 = y mol
2KNO3 to→ 2KNO2 + O2
x x 0,5x (mol)
2Mg(NO3) to→ 2MgO + 4NO2 + O2
y y 2y 0,5y (mol)
mrắn = 85x + 40y = 16,5
mkhí = 0,5x + 2,5y = 0,55
⇒ x = 0,1 mol; y = 0,2 mol
⇒ m = 0,1.101 + 0,2.148 = 39,7g
%mKNO3 = 0,1.101/39,7.100% = 25,44%
⇒ Đáp án C
Ví dụ 2 : Nhiệt phân hoàn toàn 82,4g hỗn hợp X gồm AgNO3 và Fe(NO3)3. Dẫn từ từ lượng khí sinh ra vào 2l H2O thì thu được dung dịch Y và vẫn còn 1,12 lít khí không bị hấp thụ. pH của dung dịch Y là:
A. 0,52 B. 1 C. 1,2 D. 2
Hướng dẫn giải:
Gọi nAgNO3 = x mol; nFe(NO3)3 = y mol
⇒ 170x + 242y =82,4g (1)
2AgNO3 to→ 2Ag + 2NO2 + O2
x x x 0,5x (mol)
4Fe(NO3)3 to→ 2Fe2O3 + 12NO2 + 3O2
y 3y 0,75y
nNO2 = x + 3y; nO2 = 0,5x + 0,75y
4NO2 + O2 + 2H2O → 4HNO3
Khí không bị hấp thụ thoát ra là O2 dư
nO2 pư = 1/4 nNO2 = 0,25x + 0,75y
nO2 dư = 0,25x = 0,05 mol ⇒ x = 0,2 mol
Từ (1) ⇒ y =0,2 mol ⇒ nHNO3 = 3y = 0,6 mol
[H+] = 0,6 : 2 = 0,3M ⇒ pH = -lg[H+] = 0,52
⇒ Đáp án A
Phương pháp:
- Dung dịch NH3 ( NH4OH) có tính bazơ
- Dung dịch amoniac có khả năng hòa tan các hiđroxit của các kim loại Cu, Ag, Zn
- Khí NH3 có tính khử
Ví dụ 1 : Cho lượng khí NH3 đi từ từ qua ống sứ chứa 3,2g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn ; thu được rắn A và 1 hỗn hợp khí B. Chất rắn A phản ứng vừa đủ với 20 ml HCl 1M. Thể tích khí N2 tạo thành là:
A. 2,24 lít B. 0,224 lít C. 0,298 lít D. 0,896 lít
Hướng dẫn giải:
nCuO = 0,04 mol
Chất rắn A + 0,02 mol HCl ⇒ Trong A có CuO còn dư
CuO + 2HCl → CuCl2 + H2O
0,01 ← 0,02 (mol)
⇒ nCuO pư với NH3 = 0,04 – 0,01 = 0,03 mol
3CuO + 2NH3 → 3Cu + N2 + 3H2O
0,03 0,01 (mol)
VN2 = 0,01.22,4 = 0,224 lít ⇒ Đáp án A
Ví dụ 2 : Thổi từ từ 11,2 lít NH3 vào 400 gam dung dịch ZnCl2 6,8%. Khối lượng kết tủa thu được là:
A. 19,8g B.16,2g C. 17,325g D. 14,175g
Hướng dẫn giải:
nNH3 = 0,5 mol; nZnCl2 = 0,2 mol
2NH3 + 2H2O + ZnCl2 → Zn(OH)2 + 2NH4Cl
0,4 ← 0,2 → 0,2 (mol)
⇒ NH3 dư; nNH3 dư = 0,5 – 0,2.2 = 0,1 mol
Zn(OH)2 có khả năng tạo phức với NH3:
4NH3 + Zn(OH)2 → [Zn(NH3)4](OH)2
0,1 → 0,025 (mol)
nZn(OH)2 dư = 0,2 – 0,025 = 0,175 mol
m↓ = mZn(OH)2 = 0,175. 99 = 17,325g ⇒ Đáp án C
Phương pháp :
Lập tỉ lệ
+ T≤1 ⇒ Chỉ tạo muối H2PO4-, axit H3PO4 còn dư
+ T = 2 ⇒ Chỉ tạo muối HPO42-
+ T ≥ 3 ⇒ Chỉ tạo muối PO43-, kiềm dư
+ T ∈ (1 ; 2) ⇒ Tạo 2 muối H2PO4- và HPO42-
+ T ∈ (2 ; 3) ⇒ Tạo 2 muối HPO42- và PO43-
Chú ý: Nếu cho dung dịch kiềm tác dụng với P2O5 ta đưa về H3PO4 rồi giải như trên.
Ví dụ 1 : Cho 100 ml dung dịch H3PO4 0,2 M vào 1 lit dung dịch Ca(OH)2 0,012 M. Khối lượng mỗi muối tạo thành sau khi phản ứng xảy ra hoàn toàn là:
A. Ca3(PO4)2 3,24g; CaHPO4 0,544g
B. Ca(H2PO4)2 1,872g; CaHPO4 0,544g
C. CaHPO4 0,544g
D. Ca3(PO4)2 3,24g
Hướng dẫn giải:
nH3PO4 = 0,02 mol ; nOH- = 0,024 mol
nOH-/ nH3PO4 = 1,2. Tạo 2 muối H2PO4- ( x mol) và HPO42- (y mol)
Bảo toàn P ta có: nH2PO4- + nHPO42- = nH3PO4 ⇒ x + y = 0,02 (1)
Bảo toàn điện tích: 2nCa2+ = nH2PO4- + 2nHPO42-
⇒ x + 2y = 0,024 (2)
Từ (1)(2) ⇒ x = 0,016; y = 0,004
⇒ nCa(H2PO4)2 = 0,008 mol ⇒ mCa(H2PO4)2 = 0,008.234 = 1,872g
nCaHPO4 = 0,004 mol⇒ mCaHPO4 = 0,004.136 = 0,544 g
Ví dụ 2 : Cho 7,1g P2O5 vào 48g dung dịch NaOH 20%, thu được dung dịch X. Tổng khối lượng muối thu được là:
A. 8,52g B. 6,56g C. 15,08g D. 55,1g
Hướng dẫn giải:
nP2O5 = 0,05 mol; nNaOH = 0,24 mol
nH3PO4 = 2nP2O5 = 0,1 mol
nOH-/ nH3PO4 = 2,4 (2;3) ⇒ Tạo 2 muối HPO42- ( x mol) và PO43- (y mol)
Bảo toàn P: nH3PO4 = nHPO42- + nPO43-
⇒ x + y = 0,1 (1)
Bảo toàn điện tích: nNa+ = 2nHPO42- + 3nPO43-
⇒ 2x + 3y = 0,24 (2)
Từ (1)(2) ⇒ x = 0,06 mol; y = 0,04 mol
mmuối = mNa+ + mHPO42- + mPO43- = 0,24.23 + 0,06.96 + 0,04.95 = 15,08g
⇒ Đáp án C
Phương pháp:
- Phân đạm (N): Phân đạm amoni (NH4+); Phân đạm nitrat (NO3-); Phân ure ( (NH2)2CO). Độ dinh dưỡng = %mN
- Phân lân (P): Supephotphat đơn (Ca(H2PO4)2)và CaSO4 ); supephotphat kép ( chỉ chứa Ca(H2PO4)2). Độ dinh dưỡng = %mP2O5
- Phân kali (K): Độ dinh dưỡng %mK2O
Ví dụ 1 : Hàm lượng KCl có trong một loại phân kali có độ dinh dưỡng 50% là
A. 79,26%. B. 95.51%. C. 31,54%. D. 26,17%
Hướng dẫn giải:
Độ dinh dưỡng 50% ⇒ %K2O = 50%
2KCl → K2O
149g → 94 gam
x ← 50%
⇒ x = 50%. 149/94 = 79,26% ⇒Đáp án A
Ví dụ 2 : Trong 20g supephôtphat đơn có chứa 5g Ca(H2PO4)2. Độ dinh dưỡng của mẫu lân đó là:
A. 10,23% B. 12,01% C. 9,56% D. 15,17%
Hướng dẫn giải:
Ca(H2PO4)2 → P2O5
234gam → 142 gam
5 → 5.142/234 = 3,03 gam
⇒ %P2O5 = 3,03/20 100% = 15,17% = Độ dinh dưỡng
⇒ Đáp án D