Tailieumoi.vn biên soạn và giới thiệu các kiến thức trọng tâm về Flo (F) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Flo, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Flo (F): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Flo là một phi kim hay còn được gọi là một halogen
- Kí hiệu: F
- Cấu hình electron: 1s22s22p5
- Số hiệu nguyên tử: Z = 9
- Khối lượng nguyên tử: 19
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 9, nhóm VIIA
+ Chu kì: 2
- Độ âm điện: 3,98
- Ở điều kiện bình thường, flo là chất khí màu lục nhạt, rất độc.
Nhận xét: - Flo là một phi kim điển hình có tính oxi hóa mạnh, mạnh nhất trong các phi kim.
- Flo chỉ thể hiện tính oxi hóa, không thể hiện tính khử
1. Tác dụng với kim loại
Flo oxi hóa được hầu hết kim loại, kể cả Au, Pt
2. Tác dụng với hiđro
Phản ứng nổ mạnh ngay ở nhiệt độ thấp, tỏa nhiệt mạnh
3. Tác dụng với nước
Lưu ý: F2 không đẩy được Cl, Br, I ra khỏi dung dịch muối
4. Tác dụng với phi kim
F2 tác dụng với nhiều phi kim (trừ oxi và nitơ), đưa phi kim lên trạng thái oxi hóa cao nhất
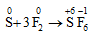
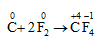
- Trong tự nhiên, flo chỉ tồn tại ở dạng hợp chất, không tồn tại đơn chất. Hợp chất flo có trong men răng người và động vật, trong lá của một số loài cây. Phần lớn flo nằm trong 2 khoáng vật chính là
+ Florit: CaF2
+ Criolit: 3 NaF.AlF3 hay Na3AlF6
Vì flo có tính oxi hóa mạnh nhất nên phương pháp duy nhất để điều chế flo là dùng dòng điện để oxi hóa ion F- trong florua nõng chảy (phương pháp điện phân). Trong công nghiệp, người ta điện phân hỗn hợp KF + 2HF (nhiệt độ nóng chảy ). Bình điện phân có cực âm làm bằng thép đặc biệt hay đồng, và cực dương làm bằng than chì. Khí hiđro thoát ra ở cực âm và khí flo thoát ra ở cực dương.
- Làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa
- Sản xuất polime: -(CF2-CF2)- teflon
- Sản xuất các hợp chất CFC: CFCl3,CF2Cl2 ,…. – chất sinh hàn
- Khí hiđro florua, axit flohiđric (HF)
- Hợp chất của flo với oxi: OF2
VIII. Bài tập liên quan về Flo (F)
Câu 1: Tính oxi hóa của Br2
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Lời giải:
Đáp án C
Tính oxi hóa giảm dần theo thứ tự Flo → Clo → Brom → Iot.
Câu 2: Trong hợp chất, nguyên tố Flo thể hiện số oxi hóa là
A. 0. B. +1.
C. -1. D. +3.
Lời giải:
Đáp án C
Nguyên tố Flo có độ âm điện lớn nhất nên phi kim có tính oxi hóa mạnh nhất. Trong hợp chất Flo chỉ thể hiện số oxi hóa -1.
Câu 3: Phát biểu nào sau đây là sai
A. Trong tự nhiên, flo chỉ có ở dạng hợp chất.
B. Trong hợp chất, các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7.
C. Tính oxi hóa của các halogen giảm dần từ flo đến iot
D. Các halogen khá giống nhau về tính chất hóa học.
Lời giải:
Đáp án B
Trong hợp chất, flo chỉ thể hiện số oxi hóa là -1.
Câu 4: Trong các chất sau, chất nào có tính oxi hóa mạnh nhất?
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án A
Nguyên tố Flo có độ âm điện lớn nhất nên phi kim có tính oxi hóa mạnh nhất.
Câu 5: Phản ứng nào sau đây là sai?
A. 2F2 + 2H2O → 4HF + O2.
B. Cl2 + H2O ⇆ HCl + HClO.
C. Br2 + H2O ⇆ HBr + HBrO.
D. F2 + H2O ⇆ HF + HFO.
Lời giải:
Đáp án D
Flo có tính oxi hóa rất mạnh, hơi nước có thể bốc cháy ngay khi gặp F2.
Câu 6: Halogen nào được ứng dụng để tạo hợp chất chống dính trong xoong, chảo, nồi cơm điện… ?
A. Flo. B. Iot.
C. Brom. D. Clo.
Lời giải:
Đáp án A
Hợp chất của Flo được ứng dụng để chế tạo hợp chất chống dính.
Câu 7: Cho 5,965 gam hỗn hợp A gồm: NaX, NaY (X,Y là hai halogen liên tiếp, nguyên tử khối của X < Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 1,435 gam kết tủa. Hai nguyên tố X, Y lần lượt là
A. F và Cl. B. Cl và Br.
C. Br và I. D. Cl và F.
Lời giải:
Đáp án A
Trường hợp 1: X là Flo và Y là Clo. Ta có PTHH:
mNaCl = 0,01.58,5 = 0,585 < 5,965 (thỏa mãn)
Trường hợp 2: X khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH:
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE
Giải PT ⇒ ME < 0 (loại).