Tailieumoi.vn biên soạn và giới thiệu các kiến thức trọng tâm về Iot (I) bao gồm định nghĩa, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế của Iot, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Iot (I): Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
- Iot là một phi kim hay còn được gọi là một halogen
- Kí hiệu: I
- Cấu hình electron:[Kr]4d105s25p5
- Số hiệu nguyên tử: Z = 53
- Khối lượng nguyên tử: 127
- Vị trí trong bảng tuần hoàn:
+ Ô, nhóm: ô số 53, nhóm VIIA
+ Chu kì: 5
- Độ âm điện: 2,66
- Ở điều kiện bình thường, iot là chất rắn, dạng tinh thể, có màu đen tím.
- Khi đun nóng, iot thăng hoa: I2 (tt)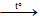
- Iot tan ít trong nước, tan nhiều trong dung môi hữu cơ: etanol, ete,…
- Iot tạo thành với hồ tinh bột hợp chất có màu xanh → dùng hồ tinh bột để nhận biết iot.
Nhận xét: Iot là một chất có tính oxi hóa nhưng kém brom
1. Tác dụng với kim loại
Iot oxi hóa được nhiều kim loại trong điều kiện đun nóng hoặc có chất xúc tác
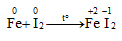
Không xảy ra phản ứng: FeI2 + I2 →
2. Tác dụng với hiđro
Iot chỉ oxi hóa được hiđro ở nhiệt độ cao, có chất xúc tác, phản ứng thuận nghịch và thu nhiệt
3. Tác dụng với nước và với dung dịch kiềm
* Khi tác dụng với nước:
* Khi tác dụng với kiềm:
Chú ý: Trong các phản ứng trên, clo vừa là chất oxi hóa, vừa là chất khử.
4. Tác dụng với Cl2/H2O
Iot chỉ tồn tại ở dạng hợp chất, hợp chất của iot tồn tại trong nước biển, rong biển nhưng ít hơn so với các halogen khác.
* Điều chế iot đi từ rong biển, việc điều chế iot dựa vào sự oxi hóa ion I-
- Muối iot: NaCl + (KI + KIO3) → phòng, chữa bệnh bướu cổ
- Chất sát trùng: cồn iot 5%
- Điều chế dược phẩm
- Khí hiđro iotua, axit iothiđric (HI)
- Muối iotua (I- )
VIII. Bài tập liên quan về Iot
Câu 1: Tính oxi hóa của Br2
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Lời giải:
Đáp án C
Tính oxi hóa giảm dần theo thứ tự Flo → Clo → Brom → Iot.
Câu 2: Phản ứng giữa hiđro và chất nào sau đây là phản ứng thuận nghịch?
A. Flo. B. Clo.
C. Iot. D. Brom.
Lời giải:
Đáp án C
Câu 3: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. sự thăng hoa. B. sự bay hơi.
C. sự phân hủy. D. sự ngưng tụ.
Lời giải:
Đáp án A
Quá trình chất chuyển từ trạng thái rắn sang trạng thái hơi, không qua trạng thái lỏng gọi là quá trình thăng hoa.
Câu 4: Thuốc thử để nhận ra iot là
A. hồ tinh bột. B. nước brom.
C. phenolphthalein. D. quì tím.
Lời giải:
Đáp án A
Iot làm xanh hồ tinh bột.
Câu 5: Trong các chất sau, chất nào có tính khử mạnh nhất?
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án D
Iot có bán kính nguyên tử lớn hơn F, Cl, Br nhưng có độ âm điện nhỏ nhất so với các nguyên tố trên, do đó Iot có tính khử mạnh nhất.