Tailieumoi.vn giới thiệu Giải bài tập Hóa Học lớp 11 Bài 8: Amoniac và muối amoni chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Amoniac và muối amoni lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 8: Amoniac và muối amoni
Câu hỏi và bài tập (trang 37 sgk Hóa học 11)
Bài 1 trang 37 sgk hóa học 11: Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh rằng ammoniac tan nhiều trong nước.
Lời giải
Nạp đầy khí NH3 vào bình thủy tinh trong suốt, đậy bình bằng ống cao su có ống thủy tinh vuốt nhọn xuyên qua. Nhúng dần ống thủy tinh vào một chậu thủy tinh chứa nước có pha vài giọt dung dịch phenolphtalein, ta thấy nước trong chậu phun vào bình thành những tia màu hồng. Đó là do khí NH3 tan nhiều trong nước làm giảm áp suất trong bình và nước bị hút vào bình. Tia nước có màu hồng chứng tỏ dung dịch có tính bazơ.
Bài 2 trang 37 sgk hóa học 11: Hoàn thành sơ đồ chuyển hóa sau đây và viết các phương trình hóa học:
![]()
Biết rằng A là hợp chất của nitơ.
Lời giải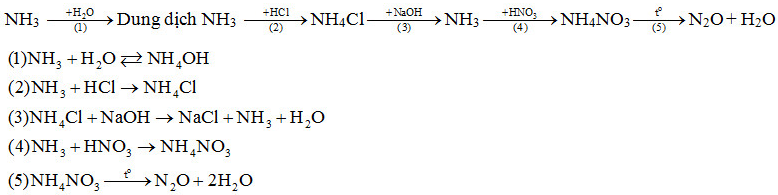
Bài 3 trang 37 sgk hóa học 11: Hiện nay, để sản xuất ammoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hóa có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.Hãy viết các phương trình hóa học của phản ứng điều chế hiđro, loại khí oxi và tổng hợp khí ammoniac.
Lời giải
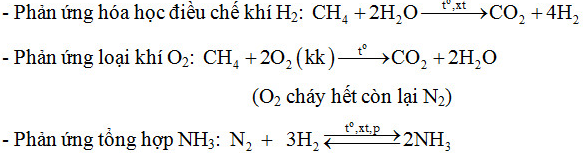
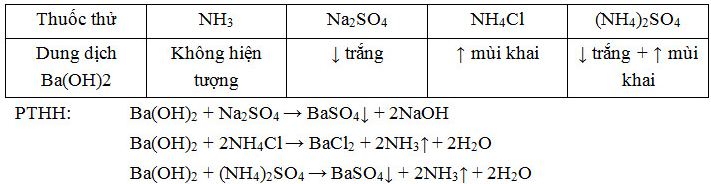
Bài 4 trang 38 sgk hóa học 11: Trình bày phương pháp hóa học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hóa học của các phản ứng đã dùng.
Lời giải
Bài 5 trang 38 sgk hóa học 11: Muốn cho cân bằng của phản ứng tổng hợp amoniac chuyển dịch sang phải, cần phải đồng thời :
A. tăng áp suất và tăng nhiệt độ.
B. giảm áp suất và giảm nhiệt độ.
C. tăng áp suất và giảm nhiệt độ.
D. giảm áp suất và tăng nhiệt độ.
Lời giải
![]()
Vậy để cân bằng chuyển dịch sang phải tức là chuyển dịch theo chiều thuận thì ta cần:
- Làm cho cân bằng chuyển dịch theo chiều tỏa nhiệt => giảm nhiệt độ vì phản ứng này là phản ứng tỏa nhiệt
- Làm cân bằng chuyển dịch theo chiều làm giảm số mol phân tử khí => tăng áp suất vì sau phản ứng số mol khí giảm.
Đáp án C
Bài 6 trang 38 sgk hóa học 11: Trong phản ứng nhiệt phân các muối NH4NO2 và NH4NO3, số oxi hóa của nitơ biến đổi như thế nào ? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hóa ?
Lời giải

Bài 7 trang 38 sgk hóa học 11: Cho dung dịch NaOH dư vào 150,0 ml dung dịch (NH4)2SO4 1,00 M, đun nóng nhẹ.
a) Viết phương trình hóa học ở dạng phân tử và dạng ion rút gọn.
b) Tính thể tích khí (đktc) thu được.
Lời giải
Bài 8 trang 38 sgk hóa học 11: Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,0 gam NH3 ? Biết rằng hiệu suất chuyển hóa thành amoniac là 25,0 %. Các thể tích khí được đo ở đktc.
A. 44,8 lít N2 và 134,4 lít H2
B. 22,4 lít N2 và 134,4 lít H2
C. 22,4 lít N2 và 67,2 lít H2
D. 44,8 lít N2 và 67,2 lít H2
Lời giải
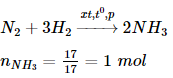
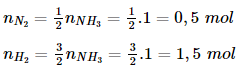
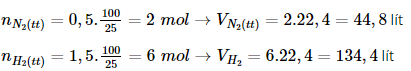
Lý thuyết Amoniac và muối amoni
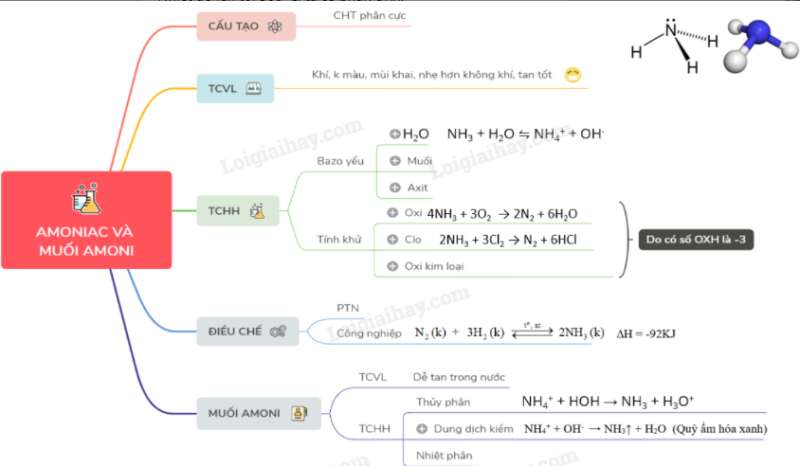
I. CẤU TẠO
- Phân tử NH3 có cấu tạo hình chóp, với nguyên tử nitơ ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên từ hiđro.
- Ba liên kết N-H đều là liên kết cộng hóa trị có cực, các cặp electron chung đều lệch về phía nguyên tử nitơ
=> NH3 là phân tử có cực.
II. TÍNH CHẤT VẬT LÍ
Amoniac là chất khí không màu, mùi khai và sốc, nhẹ hơn không khí; tan tốt trong nước
III. TÍNH CHẤT HÓA HỌC
1. Tính bazo yếu
- Do có cặp electron tự do nên NH3 dễ nhận H+, thể hiện tính bazơ yếu(tác dụng với nước tạo dung dịch làm quỳ tím hóa xanh, tác dụng với axit, tác dụng với dung dịch muối).
a) Tác dụng với nước:
NH3 + H2O ↔ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
b) Tác dụng với dung dịch muối:
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Lưu ý: Al(OH)3 không tan được trong dung dịCh NH3
c) Tác dụng với axit tạo muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2. Tính khử
- Nitơ trong NH3 có mức oxi hóa thấp nhất (-3) nên NH3 thể hiện tính khử mạnh như tác dụng với oxi, clo và một số oxit kim loại.
a) Tác dụng với oxi:
4NH3 + 3O2 . 2N2 + 6H2O
- Nếu có Pt là xúc tác, ta thu được khí NO.
4NH3 + 5O2 4NO + 6H2O
b) Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
=> NH3 kết hợp ngay với HCl vừa sinh ra tạo “ khói trắng” NH4Cl
c) Tác dụng với oxit kim loại:
2NH3 + 3CuO 3Cu + N2 + 3H2O
IV. ĐIỀU CHẾ
1. Trong phòng thí nghiệm
NH3 được điều chế bằng cách cho muối amniac tác dụng với chất kiềm khi đun nóng nhẹ. Để điều chế nhanh một lượng nhỏ khí ammoniac người ta thường đun nóng dung dịch ammoniac đặc.
2. Trong công nghiệp
Amoniac được tổng hợp từ khí N2 và khí H2 theo phản ứng:
N2 (k) + 3H2(k) ⇔ 2NH3 (k); ∆H = -92 kJ
V. MUỐI AMONI
Là những chất tinh thể ion, phân tử gồm cation amoni NH4+ và anion gốc axit.
1. Tính chất vật lí
Tất cả các muối amoni đều dễ tan trong nước và khi tan điện li hoàn toàn thành các ion.
2. Tính chất hóa học
a) Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
b) Tác dụng với dung dịch kiềm: (nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
![]()
c) Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
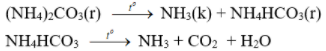
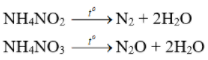
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
Sơ đồ tư duy: Amoniac và muối amoni
Phương pháp giải một số dạng bài tập về amoniac và muối amoni
Dạng 1: Lý thuyết về amoniac và muối amoni
* Một số lưu ý cần nhớ:
- Amoniac là chất khí không màu, có mùi khai xốc, nhẹ hơn không khí, tan rất nhiều trong nước. Khi hòa tan vào nước ta có được dung dịch amoniac.
- Amoniac có tính bazo yếu, và tính khử mạnh (tác dụng với oxi, clo, oxit kim loại trung bình)
- Người ta thường điều chế NH3 trong PTN bằng cách nhiệt phân muối NH4NO2 và điều chế trong công nghiệp bằng cách tổng hợp N2 và H2 ở nhiệt độ và áp suất cao
- Muối amoni tan nhiều trong nước và dễ bị nhiệt phân, tác dụng với dung dịch kiềm sinh ra khí NH3.
* Một số ví dụ điển hình:
Ví dụ 1: Cho các oxit kim loại: CuO, FeO, Al2O3, Na2O, PbO, CaO. Số oxit NH3 có thể khử được:
A. 2
B. 3
C. 4
D. 5
Hướng dẫn giải chi tiết:
NH3 chỉ khử được CuO, FeO, PbO
=> khử được 3 chất .
Đáp án B
Ví dụ 2: Phản ứng của NH3 với Cl2 tạo ra “khói trắng” . Chất này có công thức phân tử là :
A. HCl
B. N2
C. NH3+Cl-
D. NH4Cl
Hướng dẫn giải chi tiết:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 khí + HClkhí → NH4Cl (khói trắng)
Đáp án D
Ví dụ 3: Phản ứng nào dưới đây NH3 không đóng vai trò chất khử?
A. 4NH3 + 5O2 4NO + 6H2O
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
D. NH3 + 3CuO 3Cu + N2 + 3H2O
Hướng dẫn giải chi tiết:
Phản ứng mà số oxi hóa của N trong NH3 không tăng sau phản ứng thì NH3 không đóng vai trò chất khử
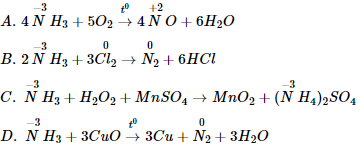
Ta thấy phản ứng ở đán án C NH3 không có sự thay đổi số oxi hóa trước và sau phản ứng → không đóng vai trò là chất khử.
Các phản ứng còn lại số oxi hóa của N trong NH3 đều tăng sau phản ứng nên NH3 đóng vai trò là chất khử
Đáp án C
Ví dụ 4: Phương trình phản ứng nhiệt phân nào sau đây sai?
A. (NH4)2CO3 2NH3 + CO2 + H2O.
B. NH4NO3 NH3 + HNO3.
C. NH4NO2 N2 + 2H2O.
D. NH4Cl NH3 + HCl
Hướng dẫn giải chi tiết:
Sai sửa lại: NH4NO3 N2O + 2H2O
Đáp án B
Ví dụ 5: Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
A. Dung dịch NaCl.
B. Dung dịch NaOH.
C. Dung dịch phenolphtalein
D. Dung dịch Ba(OH)2.
Hướng dẫn giải chi tiết:
Ta dùng NaOH vì
|
|
NH4Cl |
Na2SO4 |
Ba(HCO3)2 |
|
NaOH |
Tạo khí mùi khai |
Không hiện tượng |
Kết tủa trắng |
Đáp án B
Dạng 2: Một số bài tập về tính chất hóa học của amoniac
* Một số ví dụ điển hình:
Ví dụ 1: Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
A. 9,8 gam
B. 4,9 gam
C. 7,8 gam
D. 5 gam
Hướng dẫn giải chi tiết:
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức
=> kết tủa thu được chỉ gồm Al(OH)3
nAl(OH)3 = nAlCl3 = 0,1 mol => m = 7,8 gam
Đáp án C
Ví dụ 2: Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
Hướng dẫn giải chi tiết:
nNH3=0,1mol.nCuO=0,4mol
- Phương trình phản ứng :
2NH3 + 3CuO 3Cu + N2 + 3H2O (1)
mol: 0,1 0,4 0,15
=> nCuO dư = 0,4 - 0,15 = 0,25mol
A gồm Cu (0,15 mol) và CuO dư (0,25 mol)
- Phản ứng của A với dung dịch HCl :
CuO + 2HCl CuCl2 + H2O (2)
mol: 0,25 0,5
Theo (2) và giả thiết ta suy ra : VHCl =0,5/2 = 0,25 lít
Dạng 3: Bài toán về tính chất của muối amoni
* Một số lưu ý cần nhớ:
- Muối amoni có khả năng tác dụng với dung dịch kiềm sinh ra khí NH3 bay lên.
Ta có phương trình:
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
PT ion: NH4+ + OH- → NH3 + H2O
- Muối amoni của gốc axit không có tính OXH khi đun nóng bị phân hủy thành NH3
VD: NH4Cl; (NH4)2CO3; …
Muối amoni của gốc axit có tính OXH khi đun nóng bị phân hủy thì cho ra N2, N2O.
VD: NH4NO2; NH4NO3; …
* Một số ví dụ điển hình:
Ví dụ 1: Cho dung dịch NH4NO3 tác dụng với dung dịch bazơ của kim loạithu được 4,48 lít khí (đktc) và 26,1 gam muối. Kim loại đó là
A. Ca
B. Mg
C. Cu
D. Ba
Hướng dẫn giải chi tiết:
nNH4NO3 + M(OH)n -> M(NO3)n + nNH3 +nH2O
0,2/n 0,2
=> Mmuối = M+ 62n= 26,1 : 0,2 * n
=> M=68,5n => n = 2 và M là Bari.
Đáp án D
Ví dụ 2: Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là:
Hướng dẫn giải chi tiết:
Theo PTHH: = 5,6 : 22,4 = 0,25 mol
=> CM = n : V = 0,25 : 0,1 = 2,5M
Ví dụ 3: Thể tích N2 thu được khi nhiệt phân hoàn toàn 16 gam NH4NO2 là
A. 1,12 lít
B. 11,2 lít
C. 0,56 lít
D. 5,6 lít
Hướng dẫn giải chi tiết:
nNH4NO2 = 16 : 64 = 0,25 mol
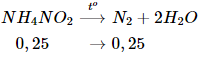
=> V N2 = 0,25.22.4 = 5,6 lít
Đáp án D.