Với tóm tắt lý thuyết Hóa học lớp 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base sách Cánh diều hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 11.
Lý thuyết Hóa học lớp 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
A. Lý thuyết pH của dung dịch. Chuẩn độ acid – base
I. pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
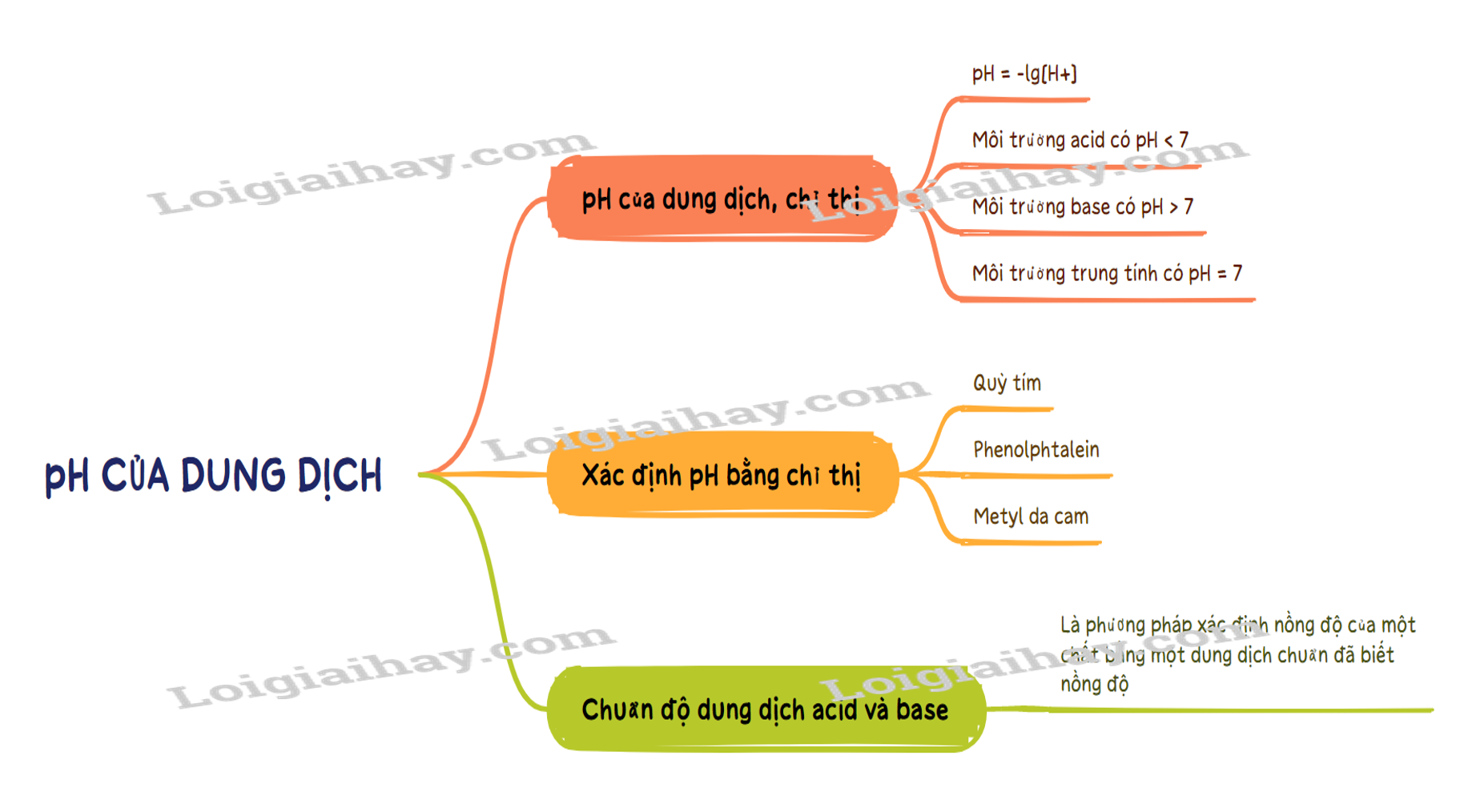
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
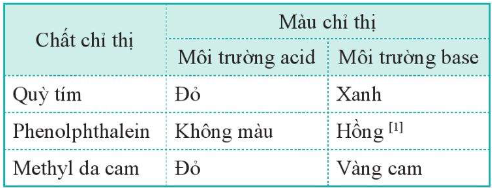
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
3. Xác định pH bằng chất chỉ thị
II. Chuẩn độ dung dịch acid và base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
Sơ đồ tư duy pH của dung dịch. Chuẩn độ acid – base
B. Trắc nghiệm pH của dung dịch. Chuẩn độ acid – base
Câu 1. Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong (1) … vào dung dịch đựng trong bình tam giác. Dụng cụ cần điền vào (1) là
A. bình định mức.
B. burette.
C. pipette.
D. ống đong.
Đáp án đúng là: B
Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong burette vào dung dịch đựng trong bình tam giác.
Câu 2. Một dung dịch có pH = 11,7. Nồng độ ion hydrogen (H+) của dung dịch là
A. 2,3M.
B. 11,7M.
C. 5,0.10-3M.
D. 2,0.10-12M.
Đáp án đúng là: D
Ta có: pH = a thì [H+] = 10-a.
Vậy dung dịch có pH = 11,7 thì [H+] = 10-11,7M = 2.10-12M.
Câu 3. Calcium hydroxide rắn được hòa tan trong nước cho tới khi pH của dung dịch đạt 10,94. Nồng độ của ion hydroxide (OH−) trong dung dịch là
A. 1,1.10-11 M.
B. 3,06 M.
C. 8,7.10-4 M.
D. 1,0.10-14 M.
Đáp án đúng là: C
Ta có: pH = a thì [H+] = 10-a.
Vậy dung dịch có pH = 10,94 thì [H+] = 10-10,94M =>
Câu 4. Giá trị pH của dung dịch HCl 0,001M là
A. 3.
B. 11.
C. 12.
D. 2.
Đáp án đúng là: A
Câu 5. Giá trị pH của dung dịch H2SO4 0,005 M là
A. 2.
B. 12.
C. 10.
D. 4.
Đáp án đúng là: A
Câu 6. Dung dịch chất nào sau đây làm quỳ tím hóa đỏ?
A. HCl.
B. K2SO4.
C. KOH.
D. NaCl.
Đáp án đúng là: A
Dung dịch HCl có môi trường acid, làm quỳ tím chuyển sang màu đỏ.
Câu 7. Dung dịch nào sau đây có pH > 7?
A. NaCl.
B. NaOH.
C. HNO3.
D. H2SO4.
Đáp án đúng là: B
Dung dịch NaOH có môi trường base nên có pH > 7.
Câu 8. Dung dịch nào sau đây có pH < 7?
A. BaCl2.
B. KOH.
C. HNO3.
D. Na2SO4.
Đáp án đúng là: C
Dung dịch HNO3 có môi trường acid nên pH < 7.
Câu 9. Dung dịch nào sau đây có pH = 7?
A. NaCl.
B. NaOH.
C. HNO3.
D. H2SO4.
Đáp án đúng là: A
Dung dịch NaCl có môi trường trung tính nên có pH = 7.
Câu 10. Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thủy phân, còn cation kim loại trung bình và yếu bị thủy phân tạo môi trường acid, gốc acid yếu bị thủy phân tạo môi trường base. Dung dịch muối nào sau đây có pH > 7?
A. KNO3.
B. K2SO4.
C. Na2CO3.
D. NaCl.
Đáp án đúng là: C
Dung dịch muối Na2CO3 chứa gốc acid yếu, thuỷ phân tạo môi trường base, làm pH > 7.
Câu 11. Giá trị pH của dung dịch NaOH 0,1 M là
A. 1.
B. 13.
C. 11.
D. 3.
Đáp án đúng là: B
Câu 12: Trộn lẫn V mL dung dịch NaOH 0,01 M với V mL dung dịch HCl 0,03 M được 2V mL dung dịch Y. Dung dịch Y có pH là
A. 4.
B. 3.
C. 2.
D. 1.
Đáp án đúng là: C
Theo bài ra ta thấy, sau phản ứng HCl dư.
Câu 13. Tại khu vực bị ô nhiễm, pH của nước mưa đo được là 4,5 còn pH của nước mưa tại khu vực không bị ô nhiễm là 5,7. Nhận xét nào sau đây không đúng?
A. Nồng độ ion H+ trong dung dịch nước mưa bị ô nhiễm là 10-4,5.
B. Nồng độ ion H+ trong dung dịch nước mưa không bị ô nhiễm là 10-5,7.
C. Nồng độ ion H+ trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
D. Nồng độ ion OH- trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
Đáp án đúng là: C
Nồng độ ion H+ trong dung dịch nước mưa bị ô nhiễm là 10-4,5.
Nồng độ ion H+ trong dung dịch nước mưa không bị ô nhiễm là 10-5,7.
Lại có 10-4,5 > 10-5,7 nên nồng độ ion H+ trong nước mưa bị ô nhiễm cao hơn so với trong nước mưa không bị ô nhiễm.
Câu 14. Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanol acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH, phát biểu nào sau đây là đúng?
A. Trước khi chuẩn độ, pH của hai acid bằng nhau.
B. Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị bằng 7.
C. Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
D. Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
Đáp án đúng là: C
Cả hydrochloric acid và ethanoic acid (acetic acid) đều phản ứng với sodium hydroxide theo tỉ lệ 1 : 1 nên khi các thể tích và nồng độ bằng nhau của các acid này được chuẩn độ bằng sodium hydroxide thì cần dùng một thể tích base để đạt đến điểm chuẩn tương đương.
Câu 15. Giá trị pH của một dung dịch tăng từ 3 đến 5. Cho các nhận định sau:
(a) Nồng độ ion H+ của dung dịch giảm 20 lần.
(b) Nồng độ OH- của dung dịch khi pH = 5 là 10-9 M.
(c) Nồng độ H+ của dung dịch khi pH = 3 là 10-3 M.
(d) Dung dịch ban đầu là một acid có nồng độ H+ là 0,001 M.
(e) Dung dịch ban đầu là một base có nồng độ 0,001 M.
Số nhận định sai là
A. 2.
B. 3.
C. 4.
D. 5
Đáp án đúng là: A
Bao gồm: (a), (e).
(a) Sai vì nồng độ H+ của dung dịch giảm 100 lần.
(e) Sai vì pH = 3 nên dung dịch ban đầu là một acid có [H+] = 0,001 M.
Xem thêm các bài tóm tắt Hóa học lớp 11 Cánh Diều hay, chi tiết khác: