Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết, bài tập về tính chất hóa học của bazo và một số bazo quan trọngcó đáp án môn Hóa học lớp 9, tài liệu bao gồm 12 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Hóa học 9 Bài 7: Tính chất hóa học của bazơ
A. Lý thuyết Tính chất hóa học của bazơ
I. Tính chất chung của bazo
1. Tác dụng với chất chỉ thị màu:
+ Làm quỳ tím hóa xanh.
+ Dung dịch phenolphtalein không màu thành màu hồng.
2. Tính chất hóa học
- Tác dụng với oxit axit à muối + nước.
Ca(OH)2 + CO2 CaCO3 + H2O
2NaOH + SO2 Na2SO3 + H2O
- Tác dụng với axit à muối + nước ( pư trung hòa)
NaOH + HCl NaCl + H2O
Fe(OH)2 + H2SO4 FeSO4 + 2H2O
- Bazo không tan bị nhiệt phân hủy à oxit + nước
Cu(OH)2 CuO + H2O
VD: Fe(OH)2, Al(OH)3, Fe(OH)3,…
- bazo tác dụng với muối à bazo mới + muối mới
CuSO4 + 2KOH Cu(OH)2 + K2SO4
VD: Trình bày phương pháp hóa học để nhận biết các hợp chất sau: HCl, NaOH, Na2SO4, NaCl. Viết các PTHH xảy ra.
II. Một số bazo quan trọng
|
|
NaOH( natri hidroxit) |
Ca(OH)2 ( canxi hidroxit) |
|
TCVL |
- Chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt. - làm bục vải, giấy và ăn mòn da. |
- chất rắn : vôi tôi, dung dịch là nước vôi hoặc vôi sữa. - Dd Ca(OH)2 là chất lỏng trong suốt và ít tan trong nước.
|
|
TCHH |
- đổi màu chất chỉ thị : làm quỳ tím hóa xanh và chuyển màu dd phenolphtalein sang màu hồng. - tác dụng axit: NaOH + HNO3 NaNO3 + H2O Ca(OH)2 + H2SO4 CaSO4 + 2H2O - tác dụng với oxit axit 2NaOH + CO2 Na2CO3 + H2O Ca(OH)2 + SO2 CaSO3 + H2O - tác dụng với muối 2NaOH + CuSO4 Na2SO4 + Cu(OH)2 Ca(OH)2 + Na2CO3 CaCO3 + 2NaOH |
|
|
ứng dụng |
- sx xà phòng, chất tẩy rửa, bột giặt. - sx tơ nhân tạo - sx giấy - sx nhôm( làm sạch quặng nhôm trước khi sx) - chế biến dầu mỏ và nhiều ngành CN khác nhau |
- làm vật liệu xây dựng - khử chua đất trồng trọt - khử độc các chất thải công nghiệp, diệt trùng nước thải sinh hoạt và xác chết động vật. |
|
Sản xuất |
2NaCl + 2H2O 2NaOH + H2 + Cl2 Cực âm: Thu được H2 2H2O +2e H2 + 2OH- Cực dương: khí Clo Cl- Cl2 +2e |
|
B. Bài tập Tính chất hóa học của bazơ
Dạng 1:Dung dịch bazo tác dụng với kim loại
|
Một số dung dịch bazo có khả năng tác dụng với KL (Al, Zn, ...) Al + NaOH + H2O → NaAlO2 + 3/2 H2 Zn + 2NaOH → Na2ZnO2 + H2 |
Ví dụ 1: Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 6,72 lít khí (đktc). Thể tích dung dịch NaOH cần dùng là
Hướng dẫn giải chi tiết:
nH2(đktc) = VH2/22,4 = 6,72/22,4 = 0,3 (mol)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(mol) 0,2 ← 0,3
Theo PTHH: nNaOH = 2/3 nH2 =2/3×0,3 =0,2 (mol)
→ VNaOH = nNaOH : CM = 0,2 : 1 = 0,2 (lít) = 200 (ml)
Ví dụ 2: Cho 11,8 gam hỗn hợp X gồm Al và Cu vào dung dịch NaOH (loãng, dư). Khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít khí H2 (đktc). Khối lượng của Cu trong hỗn hợp X là bao nhiêu?
Hướng dẫn giải chi tiết:
Khi cho hỗn hợp X gồm Al và Cu vào dung dịch NaOH loãng dư thì chỉ có Al phản ứng.
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Ta có: nAl = 2/3.nH2 = 2/3.0,3 = 0,2 (mol)
→ mCu = mX - mAl = 11,8 - 0,2. 27 = 6,4 (g)
Dạng2 :Phản ứng nhiệt phân của bazo không tan
|
Ta có phương trình tổng quát: 2M(OH)n → M2On + nH2O Dựa vào phương trình hóa học, áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố để giải bài toán |
Ví dụ 1: Nhiệt phân hoàn toàn x gam Fe(OH)3 đến khối lượng không đổi thu được 24 gam chất rắn. Giá trị bằng số của x là:
Hướng dẫn giải chi tiết:
nFe2O3=24/(56*2+16*3)=0,15mol
2Fe(OH)3 → Fe2O3 + 3H2O
0,3 0,15 mol
Từ pt => nFe(OH)3=2.nFe2O3=0,3 mol
mFe(OH)3=0,3.(56+3+16.3)=32,1 gam
Ví dụ 2: Nhiệt phân hoàn toàn 19,6g Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
Hướng dẫn giải chi tiết:
nCu(OH)2 = 19,6 : (64 + 2 + 32) = 0,2 mol
Cu(OH)2 → CuO + H2O
0,2 → 0,2
Từ pt => nCuO = nCu(OH)2 = 0,2 mol
CuO + H2 → Cu + H2O
Pứ 0,2 0,2 mol
Từ pt => nCu = nCuO= 0,2 mol
=> mCu = nCu . MCu = 0,2 . 64 = 12,8g
C. Trắc nghiệm Tính chất hóa học của bazơ
Câu 1. Cho 2,24 lít khí CO2 tác dụng vừa đủ với dung dịch bari hiđroxit tạo bari cacbonat và nước. Khối lượng bari cacbonat tạo ra là:
A. 9,85 gam.
B. 19,7 gam.
C. 39,4 gam.
D. 29,55 gam.
Câu 2 Dãy các chất nào sau đây tan trong nước?
A.Al2O3,CaO,P2O5,CuO,CO2
B.CuO,CaO,P2O5,CO,CO2
C.Na2O,CaO,P2O5,SO3,SO2
D. Fe2O3, BaO, SO2, SO3, SO2
Câu 3. Tiến hành thí nghiệm như hình vẽ dưới đây:
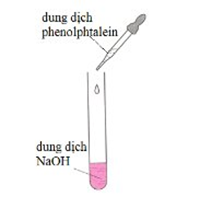
Dung dịch sau thí nghiệm chuyển từ không màu sang màu:
A. tím.
B. đỏ.
C. hồng.
D. xanh.
Câu 4. Ngâm một đinh sắt sạch trong dung dịch đồng sunfat có màu xanh. Hiện tượng xảy ra là:
Fe + CuSO4 → Cu + FeSO4
A. Chỉ có màu xanh của dung dịch ban đầu nhạt dần.
B. Chỉ một phần đinh sắt bị hoà tan.
C. Kim loại đồng màu đỏ bám ngoài đinh sắt, đinh sắt không bị hoà tan.
D. Một phần đinh sắt bị hoà tan, kim loại đồng màu đỏ bám ngoài đinh sắt, màu xanh của dung dịch ban đầu nhạt dần.
Câu 5. Bazơ nào sau đây không tan trong nước?
A. Kali hiđroxit
B. Đồng (II) hiđroxit
C. Bari hiđroxit
D. Natri hiđroxit
Câu 6. Cho các chất sau: đồng (II) hiđroxit, natri hiđroxit, bari hiđroxit, kali hiđroxit. Chất bị nhiệt phân huỷ tạo thành oxit là:
A. bari hiđroxit.
B. đồng (II) hiđroxit.
C. kali hiđroxit.
D. natri hiđroxit.
Câu 7. Phản ứng giữa cặp chất nào sau đây tạo ra sản phẩm có chất khí?
A. Dung dịch natri hiđroxit và dung dịch axit sunfuric
B. Dung dịch natri cacbonat và dung dịch bari hiđroxit
C. Dung dịch bari clorua và dung dịch natri sunfat
D. Dung dịch natri sunfit và dung dịch axit clohiđric
Câu 8. Oxit nào sau đây không được điều chế bằng phản ứng phân huỷ?
A. Na2O
B. CO2
C. SO2
D. CaO
Câu 9: Cho 18,8 gam kali oxit K2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
nK2O = 0,2 mol
a) K2O + H2O → 2KOH
0,2 → 0,4 (mol)
CM, NaOH = 0,4/0,5 = 0,8M.
b)
2KOH + H2SO4 → K2SO4 + 2H2O
0,4 → 0,2 0,4 (mol)
mH2SO4 = 0,2×98 = 19,6 g
mddH2SO4 = 19,6*100/20=98 g
Vdd = mdd/d=85,96 ml
Câu 10: Dung dịch X chứa 6,2g Na2O và 193,8g nước. Cho X vào 200g dung dịch CuSO4 16% thu được a gam kết tủa .
a. Tính nồng độ phần trăm của X.
b. Tính a.
c. Tính lượng dung dịch HCl 2M cần dùng để hòa tan hết a gam kết tủa sau khi đã nung thành chất rắn đen.
a, nNa2O = 0,1 mol.
nCuSO4 = 200.16/(100.160) = 0,2 mol
Na2O + H2O --> 2NaOH
0,1 mol 0,2 mol
Nồng độ % X (tức dung dịch NaOH) :
C% = 0,2.40.100/(6,2+193,8) = 4%
2NaOH + CuSO4 --> Cu(OH)2 + Na2SO4
0,2 mol 0,2 mol
0,2 0,1 0,1mol
a = 0,1. 98 = 9,8(g)
Cu(OH)2 → CuO + H2O
0,1 mol 0,1 mol
2HCl + CuO --> CuCl2 + H2O
0,2 mol 0,1mol
Thể tích dung dịch HCl 2M : Vdd = n/C = 0,2/2 = 0,1 lít
Câu 11:Trung hòa 300ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
a. Tính khối lượng dung dịch NaOH cần dùng.
b. Nếu thay dung dịch NaOH bằng dung dịch KOH 5,6% (D = 1,045g/ml) thì lượng KOH cần dùng là bao nhiêu?
HD:
a. H2SO4 + 2NaOH --> Na2SO4 + 2H2O
nH2SO4 = 0,3 . 1,5 = 0,45 mol
mNaOH = 2. 0,45. 40 = 36g.
Khối lượng dung dịch NaOH 40%: mdd = 36.100/40 = 90g
b. H2SO4 + 2KOH --> K2SO4 + 2 H2O
mKOH = 2 . 0,45 . 56 = 50,4g
mdd = 50,4.1005,6 = 900g
Vdd = mdd/D = 900/1,045 = 861,2 ml
Câu 11. Cho 8 gam đồng (II) oxit phản ứng với dung dịch axit clohiđric lấy dư, sau khi phản ứng hoàn toàn dung dịch thu được có chứa m gam muối đồng (II) clorua. Giá trị của m là:
A. 27.
B. 15,3.
C. 20,75.
D. 13,5.
Câu 13. Khí CO thường được dùng làm chất đốt trong công nghiệp. Một loại khí CO có lẫn tạp chất CO2, SO2. Hoá chất rẻ tiền nào sau đây có thể loại bỏ những tạp chất trên ra khỏi CO?
A. H2O cất.
B. dung dịch HCl.
C. dung dịch nước vôi trong
D. dung dịch xút.
Câu 14. Cặp chất nào sau đây khi phản ứng chỉ tạo muối và nước?
A. Dung dịch natri hiđroxit và dung dịch sắt (II) clorua.
B. Dung dịch natri cacbonat và dung dịch bari clorua.
C. Dung dịch natri cacbonat và dung dịch axit clohiđric.
D. Dung dịch natri hiđroxit và dung dịch natri hiđrocacbonat.
Câu 15. Dung dịch nào sau đây có pH > 7?
A. Dung dịch natri clorua
B. Dung dịch canxi clorua.
C. Dung dịch axit sunfuric
D. Dung dịch nước vôi trong.
Câu 16. Phản ứng giữa cặp chất nào sau đây không xảy ra?
A. Dung dịch bari hiđroxit và dung dịch axit clohiđric
B. Dung dịch đồng (II) sunfat và dung dịch natri hiđroxit
C. Dung dịch natri cacbonat và dung dịch kali clorua
D. Dung dịch bari clorua và dung dịch natri sunfat
Câu 18. Phản ứng giữa axit sunfuric và kali hiđroxit là phản ứng
A. thế.
B. trung hoà.
C. phân huỷ.
D. hoá hợp.
Câu 19. Dung dịch đồng (II) clorua tác dụng được với dung dịch:
A. axit clohiđric.
B. natri sunfat.
C. bari nitrat.
D. kali hiđroxit.
Câu 22. Cho hai dung dịch natri sunfat và natri cacbonat đều trong suốt không màu. Thuốc thử dùng phân biệt hai dung dịch trên là:
A.dung dịch natri hiđroxit.
B. dung dịch natri clorua.
C. dung dịch axit clohiđric.
D. dung dịch bari clorua.
Câu 23. Quỳ tím chuyển đỏ khi cho vào dung dịch:
A.nước vôi trong.
B. axit sunfuric.
C. natri hiđroxit.
D. kali hiđroxit.
Câu 24. Oxit nào sau đây là oxit trung tính?
A. CaO
B. CO2
C. SO2
D. CO
Câu 25. Cho các chất: CuO, BaCl2, Mg, MgO. Chất tác dụng được với dung dịch axit clohiđric tạo dung dịch màu xanh là:
A. CuO.
B. MgO.
C. Mg.
D. BaCl2
Câu 26. CaO có tên gọi thông thường là:
A. vôi bột.
B. vôi tôi.
C. vôi sống.
D. sữa vôi.
Câu 27. Axit tương ứng với lưu huỳnh (IV) oxit có công thức là:
A.H2SO3
B. H2CO3
C. H2SO4
D. H3PO4
Câu 28. Cho hai dung dịch axit clohiđric và axit sunfuric loãng. Thuốc thử dùng để phân biệt hai dung dịch trên là:
A. dung dịch natri hiđroxit.
B. sắt (II) hiđroxit.
C. dung dịch bari clorua.
D. dung dịch natri cacbonat.
Câu 29. Oxit nào sau đây là oxit axit?
A. SO2
B. Na2O
C. Al2O3
D. CO
Câu 30. Cho vài giọt dung dịch natri hiđroxit vào ống nghiệm chứa 1 ml dung dịch sắt (III) clorua. Hiện tượng xảy ra là:
A. có kết tủa trắng xanh sau chuyển màu nâu đỏ.
B. có kết tủa trắng xanh tạo ra.
C. có kết tủa xanh đậm.
D. có kết tủa nâu đỏ tạo ra.
Câu 31. Trong công nghiệp, vôi sống được điều chế bằng cách nhiệt phân:
A. CaCl2
B. CaSO4
C. Ca(OH)2
D. CaCO3
Câu 32. Oxit nào sau đây làm vẩn đục dung dịch nước vôi trong dư?
A. CO2
B. NO
C. CuO
D. CO
Câu 33. Khí sunfurơ được tạo ra từ cặp chất nào sau đây?
A. Muối natri sunfit và axit cacbonic
B. Muối natri sunfit và dung dịch axit clohiđric
C. Muối natri sunfat và dung dịch axit clohiđric
D. Muối natri sunfat và muối đồng(II) clorua