Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 29. Axit cacbonic và muối cacbonat chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Axit cacbonic và muối cacbonat lớp 9.
Giải bài tập Hóa học 9 Bài 29. Axit cacbonic và muối cacbonat
Bài 1 trang 91 SGK Hóa học 9: Hãy lấy thí dụ chứng tỏ rằng H2CO3 là axit yếu hơn HCl và là axit không bền. Viết phương trình hoá học.
Phương pháp giải:
Lời giải:
* H2CO3 là axit yếu hơn axit HCl: axit cacbonic bị axit HCl mạnh hơn đẩy ra khỏi muối.
Phương trình hóa học: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
* H2СO3 là axit không bền: Axit H2СO3 tạo thành bị phân hủy ngay thành khí CO2 và H2O
Phương trình hóa học: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Bài 2 trang 91 SGK Hóa học 9: Dựa vào tính chất hoá học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các phương trình hoá học minh hoạ.
Lời giải:
Tính chất của muối MgCO3 : xét điều kiện phản ứng, MgCO3 có các tính chất sau:
a) Tác dụng với dung dịch axit mạnh hơn tạo thành axit cacbonic: MgCO3 + 2HNO3 → Mg(NO3)2 + CO2+ H2O
b) Bị nhiệt phân hủy: MgCO3 MgO + CO2
MgCO3 không tan trong nước nên không có phản ứng với dung dịch muối và dung dịch bazơ
Bài 3 trang 91 SGK Hóa học 9: Viết các phương trình hoá học biểu diễn chuyển đổi hoá học sau:
C CO2 CaCO3 CO2
Lời giải:
Viết các phương trình hóa học biểu diễn chuyển đổi hóa học:
a) С + O2 CO2
b) CO2 + CaO CaCO3
c CaCO3 CaO + CO2
Bài 4 trang 91 SGK Hóa học 9: Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3 ; d) CaCl2 và Na2CO3 ;
b K2CO3 và NaCl; e) Ba(OH)2 và K2CO3.
c) MgCO3 và HCl;
Giải thích và viết các phương trinh hoá học.
Phương pháp giải:
Lời giải:
Các cặp chất có thể tác dụng với nhau vì tạo sản phẩm là chất khí hoặc chất không tan.
a) H2SO4 + 2KHCO3 K2SO4 + 2CO2 ↑ + 2H2O
c) MgCO3 + 2HCl MgCl2 + CO2 ↑ + Н2О
d) CaCl2 + Na2CO3 2NaCl + CaCO3↓
e) Ba(OH)2 + K2CO3 BaCO3 ↓+ 2KOH
- Cặp không xảy ra phản ứng là b) K2CO3 và NaCl, vì không có kết tủa hay chất khí nào tạo thành.
Lưu ý: Điều kiện của phản ứng trao đổi dung dịch chỉ xảy ra nếu sản phẩm có chất kết tủa (không tan) hoặc có chất khí tạo thành.
Bài 5 trang 91 SGK Hóa học 9: Hãy tính thể tích khí CO2 (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980 g H2SO4 tác dụng hết với dung dịch NaHCO3.
Lời giải:
Số mol H2SO4 trong bình chữa cháy là: 980 : 98 = 10 mol
Phương trình hóa học : H2SO4 + 2NaHCO3 -> Na2SO4 + 2CO2 + 2H2O
Theo pt, số mol CO2 tạo thành = 2.số mol H2SO4 phản ứng = 20 mol.
Thể tích khí CO2 tạo thành ở đktc = 20 x 22,4 = 448 lít.
Lý thuyết Bài 29: Axit cacbonic và muối cacbonat
I. AXIT CACBONIC (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
- Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000m3 nước hòa tan được 90 m3 khí CO2.
- Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
2. Tính chất hóa học
- H2CO3 là một axit yếu, dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
- H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
II. MUỐI CACBONAT
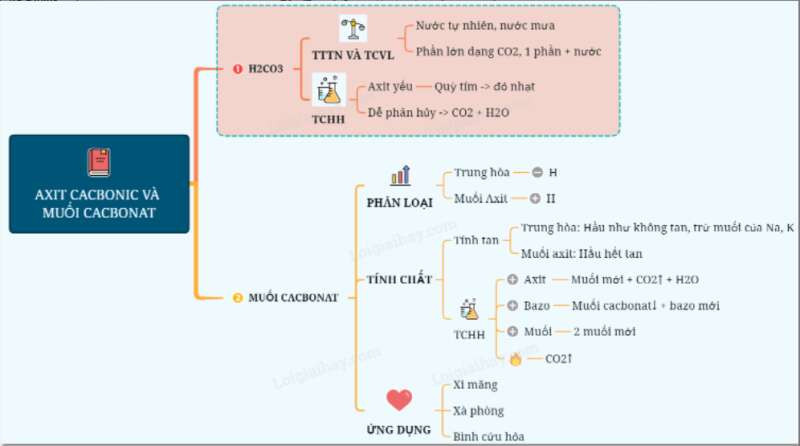
1. Phân loại:
- Muối trung hòa: Không còn nguyên tố H trong thành phần gốc axit.
Thí dụ: Na2CO3, CaCO3,..
- Muối axit: Có nguyên tố H trong thành phần gốc axit.
Thí dụ: NaHCO3, Ca(HCO3)2...
2. Tính chất
- Tính tan: Chỉ có một số muối cacbonat tan được, như Na2CO3, K2CO3... và muối axit như Ca(HCO3)2,...
- Hầu hết muối cacbonat trung hòa không tan, như CaCO3, BaC03, MgC03...
3. Tính chất hóa học
- Muối cacbonat + dd axit mạnh hơn (HCl, HNO3, H,SO4,...) → muối mới + CO2.
Phương trình hóa học:
NaHCO3 + HCl -> NaCl + CO2 + H2O
- Một số dung dịch muối cacbonat + dung dịch bazơ → muối mới + bazơ mới.
Phương trình hóa học:
K2CO3 + Ca(OH)2 -> 2KOH + CaC03
- Dung dịch muối cacbonat + một số dung dịch muối → 2 muối mới
Phương trình hóa học:
Na2CO3 + CaCl2 -> 2NaCl + CaCO3
- Nhiều muối cacbonat (trừ Na2CO3, K,CO3,... )dễ bị nhiệt phân hủy giải phóng khí CO2
Phương trình hóa học:
CaCO3 CaO + CO2
4. Ứng dụng:
- CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măngr..
- Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh,..
- NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa,...
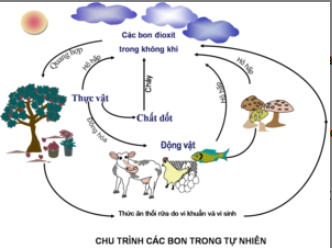
III. CHU TRÌNH CACBON TRONG TỰ NHIÊN
- Hô hấp của động vật, thực vật, đốt cháy thực vật, các thức ăn bị thối rữa do vi khuẩn và vi sinh…tạo ra lượng lớn CO2 trong khí quyển.
- Cây xanh quang hợp lấy CO2 trong khí quyển để tổng hợp diệp lục.
Sơ đồ tư duy: Axit cacbonic và muối cacbonat
Phương pháp giải một số dạng bài tập về axit hidro cacbonic và muối cacbonat có lời giải
Dạng 1: Lý thuyết về axit hidro cabonic và muối cacbonat
* Một số lưu ý cần nhớ:
1. Phân loại:
- Muối trung hòa. Không còn nguyên tố H trong thành phần gốc axit.
Thí dụ: Na2CO3, CaCO3,..
- Muối axit: Có nguyên tố H trong thành phần gốc axit.
Thí dụ: NaHCO3, Ca(HCO3)2...
2. Tính chất
- Tính tan: Chỉ có một số muối cacbonat tan dược, như Na2CO3, K2CO3... và muối axit như Ca(HCO3)2,... Hầu hết muối cacbonat trung hòa không tan, như CaCO3, BaC03, MgC03...
c) Tính chất hóa học
- Muối cacbonat tác dụng với dd axit mạnh hơn (HCl, HNO3, H,SO4,...) tạo thành muối mới và CO2.
Phương trình hóa học:
NaHCO3 + HCl -> NaCl + CO2 + H2O
- Một số dung dịch muối cacbonat tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Phương trình hóa học:
K2CO3 + Ca(OH)2 -> 2KOH + CaC03
- Dung dịch muối cacbonat tác dụng với một số dung dịch muối tạo thành 2 muối mới
Phương trình hóa học:
Na2CO3 + CaCl2 -> 2NaCl + CaCO3
- Nhiều muối cacbonat (trừ Na2CO3,... )dễ bị nhiệt phân hủy giải phóng khí CO2
Thí dụ: CaCO3 CaO + CO2
* Một số ví dụ điển hình
Câu 1: Có các chất rắn màu trắng, đựng trong các lọ riêng biệt không nhãn : CaCO3, NaCl, NaOH. Nếu dùng quỳ tím và nước thì có thể nhận ra
A. 1 chất
B. 2 chất
C. 3 chất
D. không nhận được
Hướng dẫn giải chi tiết:
- Cho nước vào các mẫu chất rắn, mẫu không tan trong nước là CaCO3, 2 mẫu tan trong nước là NaCl và NaOH
- Dùng quỳ tím để nhận biết 2 dung dịch của 2 mẫu tan, dung dịch không làm đổi màu quỳ là NaCl, dung dịch làm đổi màu quỳ là NaOH
Đáp án C
Câu 2: Có 4 chất rắn: NaCl, Na2CO3, CaCO3, BaSO4 chỉ dùng thêm một cặp chất nào dưới đây để nhận biết ?
A. H2O và CO2
B. H2O và NaOH
C. H2O và HCl
D. H2O và BaCl2
Hướng dẫn giải chi tiết:
- Cho nước cất vào cả 4 mẫu chất rắn trên, mẫu không tan trong nước là CaCO3 và BaSO4 (nhóm I), 2 mẫu tan trong nước là NaCl và Na2CO3 (nhóm II)
- Cho dung dịch HCl vào các mẫu ở cả 2 nhóm.
+ Nhóm I: mẫu xuất hiện khí thoát ra là CaCO3, mẫu không hiện tượng là BaSO4
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
+ Nhóm II: mẫu xuất hiện khí thoát ra là Na2CO3, mẫu không hiện tượng là NaCl
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Đáp án C
Câu 3: Hãy cho biết trong các cặp chất sau đây, cặp nào không thể tác dụng với nhau?
A. H2SO4 và KHCO3
B. K2CO3 và NaCl
C. MgCO3 và HCl
D. CaCl2 và Na2CO3
Hướng dẫn giải chi tiết:
Những cặp chất tác dụng với nhau:
A. H2SO4+ 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
C. MgCO3+ 2HCl → MgCl2 + CO2 ↑ + H2O
D. CaCl2+ Na2CO3 → CaCO3 ↓ + 2NaCl
Cặp chất không tác dụng với nhau là B. K2CO3 và NaCl
Đáp án B
Dạng 2: Nhiệt phân muối cacbonat
* Một số lưu ý cần nhớ
- Hầu hết các muối cacbonat đều bị nhiệt phân ở nhiệt độ cao (trừ Na2CO3, K2CO3…)
- Tất cả các muối hidro cacbonat đều bị nhiệt phân ở nhiệt độ cao
2NaHCO3 → Na2CO3 + CO2 + H2O
* Một số ví dụ điển hình
Câu 1: Nhiệt phân một thời gian 28,4 gam hỗn hợp X gồm MgCO3, CaCO3 thu được m gam chất rắn Y và 3,36 lít khí CO2 (đktc). Giá trị của m là
Hướng dẫn giải chi tiết:
Áp dụng định luật bảo toàn khối lượng
⟹ .
⟹ m = 28,4 – 0,15.44 = 21,8 gam.
Câu 2: Nung nóng m gam MgCO3 đến khi khối lượng không đổi thì thu được V lít khí CO2 ( ở đktc). Hấp thụ hoàn toàn V lít CO2 vào 400 ml dung dịch Ca(OH)2 0,1 M thì thu được 2,5 gam kết tủa và dung dịch X. Cho dung dịch NaOH dư vào X thì thu được a gam kết tủa. Giá trị của V và a là:
Hướng dẫn giải chi tiết:
nCa(OH)2=0,04 mol
nCaCO3 = 0,025 mol
Bảo toàn số mol Ca ta có nCa(OH)2 = nCaCO3 + nCa(HCO3)2
→ nCa(HCO3)2 = 0,015 mol
Bảo toàn số mol C ta có nCO2 = nCaCO3 + 2nCa(HCO3)2 → nCO2= 0,025 + 0,015.2=0,055 mol
→ V =1,232 lít
Theo PTHH thì nCaCO3(4) = nCa(HCO3)2 =0,015 mol → a =1.5g
Câu 3: Nung 4,84 gam hỗn hợp gồm NaHCO3 và KHCO3 tạo ra 0,56 lít CO2(đktc). Khối lượng mỗi chất trong hỗn hợp đã cho lần lượt là:
Hướng dẫn giải chi tiết:
2NaHCO3 Na2CO3 + H2O + CO2↑ (1)
2KHCO3 K2CO3 + H2O + CO2↑ (2)
Gọi số mol CO2 ở phương trình (1) và (2) lần lượt là x và y (mol)
Theo (1): nNaHCO3=2nCO2(1)= 2x(mol)
Theo (2): nKHCO3=2nCO2(2)= 2y(mol)
Ta có:
=> mNaHCO3= 84×2×0,005=0,84(g)
=> mKHCO3= 4,84- 0,84 = 4 (g)
Dạng 3: Muối cacbonat tác dụng với dung dịch axit
* Một số ví dụ điển hình
Câu 1: Cho 19 g hỗn hợp Na2CO3 và NaHCO3 tác dụng với một lượng vừa đủ dung dịch HCl sinh ra 4,48 lít khí (đktc). Khối lượng muối trong hỗn hợp ban đầu lần lượt là:
Hướng dẫn giải chi tiết:
nCO2(ĐKTC) = 4,48 : 22,4 = 0,2 (mol)
Gọi x, y lần lượt là số mol của Na2CO3 và NaHCO3 trong hỗn hợp ban đầu
Ta có phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O (1)
x x (mol)
NaHCO3 + HCl → 2NaCl + CO2 + H2O (1)
y y (mol)
Giải hệ phương trình:
mNa2CO3 = 0,1 × 106 = 10,6 (g)
mNaHCO3 = 0,1 ×84 = 8,4 (g)
Câu 2: Hòa tan 2 gam muối YCO3 bằng dung dịch HCl dư thu được dung dịch A và 0,224 lít CO2(đktc). Khối lượng muối trong dung dịch A là (H=1, Cl=35,5, C=12, O=16)
Hướng dẫn giải chi tiết:
PTHH: YCO3 + 2HCl → YCl2 + CO2↑ + H2O
Cách 1:
Theo PTHH: nHCl = 2nCO2 = 2.0,01 = 0,02 (mol)
nH2O = nCO2 = 0,01 (mol)
áp dụng định luật bảo toàn khối lượng ta có:
mYCO3 + mHCl = mYCl2 + mCO2 + mH2O
→ 2 + 0,02×36,5 = mYCl2 + 0,01×44 + 0,01×18
→ mYCl2 = 2,11 (g)
Cách 2: Theo PTHH: nYCO3 = nYCl2 = nCO2 = 0,01 (mol)
Ta có: cứ 1 mol YCO3 sinh ra 1 mol YCl2 thì khối lượng tăng là (Y+71)- (Y+60) = 11 (g)
Vậy cứ 0,01 mol YCO3 sinh ra 0,01 mol YCl2 thì khối lượng tăng là x = ? gam
→ x = 0,01.11/1 = 0,11 (g)
→ Khối lượng muối YCl2 thu được = mYCO3 + mtăng = 2 + 0,11 = 2,11 (g).
Câu 3: Cho 2,44 gam hỗn hợp muối Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch H2SO4 , sau phản ứng thu được 0,448 lít khí CO2 ở đktc. Tổng khối lượng muối sunfat thu được là:
Hướng dẫn giải chi tiết:
PTHH : Na2CO3 + H2SO4 → Na2SO4 +H2O + CO2
K2CO3+ H2SO4 → Na2SO4 +H2O + CO2
Đặt số mol của Na2CO3 và K2CO3 lần lượt là x và y mol → 106x + 138y = 2,44
Theo PTHH nCO2 = x+ y =0,02 mol
→ x =y = 0,01 mol
→mmuối =mK2SO4 + mNa2SO4 =3,16