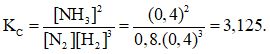Tailieumoi.vn xin giới thiệu tài liệu đầy đủ, chi tiết. Giúp các em ôn luyện, củng cố kiến thức để đạt kết quả cao trong bài thi môn Hóa học 11 sắp tới.
Trắc nghiệm Hóa học 11 Chương 1 có đáp án: Sự điện li
Trắc nghiệm Sự điện li có đáp án – Hóa học lớp 11
Bài 1: Có 4 dung dịch: Natri clorua, rượu etylic, axit axetic, kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
A. NaCl < C2H5OH < CH3COOH < K2SO4.
B. C2H5OH < CH3COOH < NaCl < K2SO4.
C. C2H5OH < CH3COOH < K2SO4 < NaCl.
D. CH3COOH < NaCl < C2H5OH < K2SO4.
Đáp án: B
Bài 2: Trong dung dịch axit nitric (bỏ qua sự phân li của H2O) có những phần tử nào ?
A. H+, NO3-.
B. H+, NO3-, H2O.
C. H+, NO3-, HNO3.
D. H+, NO3-, HNO3, H2O.
Đáp án: B
Bài 3: Trong dung dịch axit axetic (bỏ qua sự phân li của H2O) có những phần tử nào ?
A. H+, CH3COO-.
B. H+, CH3COO-, H2O.
C. CH3COOH, H+, CH3COO-, H2O.
D. CH3COOH, CH3COO-, H+.
Đáp án: C
Bài 4: Cho các chất: phèn K – Al; C2H5OH; glucozơ; saccarozơ; tinh bột; dầu ăn; CH3COOH; HCOOCH3; CH3CHO; C3H6; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2; C2H4(OH)2; Phèn amoni – sắt. Số chất điện li là:
A. 6 B. 7
C. 9 D. 8
Đáp án: B
Các chất điện li: phèn K – Al (là muối của K và Al); CH3COOH; Ca(OH)2; CH3COONH4; NaHCO3; KAlO2, Phèn amoni – sắt ( muối của sắt và amoni)
Bài 5: Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan. C. CaCl2 nóng chảy.
B. NaOH nóng chảy. D. HBr hòa tan trong nước
Đáp án: A
Bài 6: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M. B. 0,8M. C. 0,6M. D. 0,4M.
Đáp án: B
Phản ứng điện li:
MgSO4 → Mg2+ + SO42-
Al2(SO4)3 → 2Al3+ + 3SO42-
nSO42- = 0,4 mol
⇒ CM(SO42-) = 0,4 / 0,5 = 0,8 (M)
Bài 7: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3m thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là
A. 0.38M. B. 0,22M. C. 0,19M. D. 0,11M.
Đáp án: A
Bài 8: Một dung dịch chứa các ion : Cu2+ (0,02 mol), K+ (0,10 mol), NO3- (0,05 mol) và SO42- (x mol). Giá trị của x là
A. 0,050. B. 0.070. C. 0,030. D. 0,045.
Đáp án: D
Theo bảo toàn điện tích: 2nCu2+ + nK+ = nNO3- + nSO42-
⇒ 2.0,02 + 0,1 = 0,05 + 2x ⇒ x = 0,045 (mol)
Bài 9: Một dung dịch chứa Mg2+ (0,02 mol), K+ (0,03 mol) , Cl- (0,04 mol) và ion Z (y mol). Ion Z và giá trị của y là
A. NO3- (0,03). B. CO32- (0,015). C. SO42- (0,01). D. NH4+ (0,01)
Đáp án: A
Gọi điện tích của ion Z là x, số mol là y
Theo bảo toàn điện tích: 2nMg2+ + nK+ + (-1)nCl- + xy = 0
⇒ xy = -0,03
Vậy Z là anion
Đáp án phù hợp là A: x = -1, y = 0,03 mol. Anion là NO3-
Nếu x = -2, y = 0,015 mol, anion là CO32- loại, vì ion này tạo kết tủa với Mg2+
Bài 10: Dung dịch X gồm : 0,09 mol Cl- , 0,04 mol Na+ , a mol Fe3+ và b mol SO . Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05. B. 0,03 và 0,02.
C. 0,07 và 0,08. D. 0,018 và 0,027.
Đáp án: B
Theo bảo toàn điện tích: 3a + 0,04 = 0,09 + 2b (1)
Theo bảo toàn khối lượng: 56a + 0,04. 23 + 0,09. 35,5 + 96b = 7,715 (2)
Giải hệ 1 và 2 ⇒ a = 0,03 và b = 0,02
Bài 11: Phương trình điện li nào sau đây không đúng ?
A. HCl → H+ + Cl-
B. CH3COOH ⇌ CH3COO- + H+
C. H3PO4 → 3H+ + PO43-
D. Na3PO4 → 3Na+ + PO43-
Đáp án: C
Bài 12: Phương trình điện li nào sau đây viết đúng ?
A. H2SO4 ⇌ H+ + HSO4-
B. H2CO3 ⇌ 2H+ + HCO3-
C. H2SO3 → 2H+ + SO32-
D. Na2S ⇌ 2Na+ + S2-
Đáp án: B
Bài 13: Các chất dẫn điện là
A. KCL nóng chảy, dung dịch NaOH, dung dịch HNO3.
B. dung dịch glucozơ , dung dịch ancol etylic , glixerol.
C. KCL rắn khan, NaOH rắn khan, kim cương.
D. Khí HCL, khí NO, khí O3.
Đáp án: A
Bài 14: Dãy các chất đều là chất điện li mạnh là
A. KOH, NaCL, H2CO3.
B. Na2S, Mg(OH)2 , HCl.
C. HClO, NaNO3, Ca(OH)3.
D. HCl, Fe(NO3)3, Ba(OH)2.
Đáp án: D
Bài 15: Trong dung dịch CH3COOH 0,043M, cứ 100 phân tử hòa tan có 2 phân tử phân li thành ion. Nồng độ của ion H+ là
A. 0,001M. B. 0,086M. C. 0,00086M. D. 0,043M.
Đáp án: C
Độ điện li của CH3COOH là 0,02.
CM H+ = 0,043. 0,02 = 0,00086 (mol)
Trắc nghiệm Axit, bazơ, muối có đáp án – Hóa học lớp 11
Bài 1: Theo định nghĩa về axit - bazơ của Bron - stêt có bao nhiêu ion trong số các ion sau đây là bazơ: Na+, Cl-, CO32-, HCO3-, CH3COO-, NH4+, S2- ?
A. 1. B. 2.
C. 3. D. 4.
Đáp án: C
CO32- + 2H2O ⇆ H2CO3 + 2OH-
CH3COO- + H2O ⇆ CH3COOH + OH-
S2- + 2H2O ⇆ H2S + 2OH-
Bài 2: Cho các ion sau:
(a) PO43- (b) CO32- (c) HSO3- (d) HCO3- (e) HPO32-
Theo Bron-stêt những ion nào là lưỡng tính ?
A. (a), (b). B. (b), (c).
C. (c), (d). D. (d), (e).
Đáp án: C
HSO3- + H2O ⇆ H2SO3 + OH-
Axit: HSO3- + H2O ⇆ SO32- + H3O+
HCO3- tương tự
Bài 3: Chọn các chất là hiđroxit lưỡng tính trong số các hiđroxit sau:
A. Zn(OH)2, Cu(OH)2. B. Al(OH)3, Cr(OH)2
C. Sn(OH)2, Pb(OH)2. D. Cả A, B, C.
Đáp án: D
Bài 4: Cho các chất và ion sau: HCO3-, Cr(OH)3, Al, Ca(HCO3)2, Zn, H2O, Al2O3, (NH4)2CO3, HS-, Zn(OH)2, Cr2O3, HPO42-, H2PO4-, HSO3-. Theo Bron-stêt có bao nhiêu chất và ion là lưỡng tính ?
A. 12. B. 11.
C. 13. D. 14.
Đáp án: A
HCO3-, Cr(OH)3, Ca(HCO3)2, H2O, Al2O3, HS-, Zn(OH)2, Cr2O3, HPO42-, H2PO4-, HSO3-
Bài 5: Dãy chất và ion nào sau đây có tính chất trung tính ?
A. Cl-, Na+, NH4+.
B. Cl-, Na+, Ca(NO3)2.
C. NH4+, Cl-, H2O.
D. ZnO, Al2O3, Ca(NO3)2.
Đáp án: B
Bài 6: Cần bao nhiêu ml dung dịch NaOH 0,5M để phản ứng vừa đủ với 50 ml dung dịch NaHCO3 0,2M ?
A. 100 ml.B. 50 ml. C. 40 ml. D. 20 ml.
Đáp án: D
Phản ứng: NaOH + NaHCO3 → Na2CO3 + H2O
⇒ NaOH và NaHCO3 phản ứng theo tỉ lệ 1 : 1.
Ta có: CNaOH.VNaOH = CNaHCO3.VNaHCO3 ⇒ VNaOH = 20 ml
Bài 7: Cho 8 gam hỗn hợp X gồm Mg và Fe vào dung dịch hcl dư. Sau khi phản ứng xảy ra hoàn toàn , khối dung dịch tăng 7,6 gam. Số mol Mg trong X là
A. 0,05 mol. B. 0,075 mol. C. 0,1 mol. D. 0,15 mol.
Đáp án: C
nFe = x mol; nMg = y mol
X + HCl → Muối + H2
mdung dịch tăng = mX – mH2
m2 = 0,4 gam ⇒ nH2 = 0,2 mol
Ta có: nFe + nMg = x + y = nH2 = 0,2 mol (1)
56x + 24y = 8 gam (2)
Từ (1) và (2) ⇒ x = 0,1; y = 0,1 mol
Bài 8: Hòa tan ba muối X, Y, Z vào nước thu được dung dịch chứa: 0,40 mol K+; 0,20 mol Al3+: 0,2 mol SO42- và a mol Cl-. Ba muối X, Y, Z là
A. KCl, K2SO4, AlCl3.
B. KCl, K2SO4, Al2(SO4)3.
C. KCl, AlCl3, Al2(SO4)3.
D. K2SO4, AlCl3, Al2(SO4)3.
Đáp án: C
Bảo toàn điện tích ⇒ a = 0,6
Xét đáp án:
Đáp án A: SO42- chỉ ở K2SO4 ⇒ K+ ở K2SO4 là 0,4 mol (đủ)
⇒ không có KCl ⇒ loại
Đáp án B: Cl- chỉ có ở KCl ⇒ K+ ở KCl là 0,6 mol (dư) ⇒ loại
Đáp án C: 0,4 mol KCl; 0,2/3 mol AlCl3; 0,2/3 mol Al2(SO4)3
⇒ Chọn đáp án C
Đáp án D: Cl- chỉ ở AlCl3 ⇒ Al3+ là 0,2 mol (đủ) ⇒ không có Al2(SO4)3 ⇒ loại
Bài 9: Khi cho 100ml dung dịch NaOH 1M vào 100 ml dung dịch HNO3 xM, thu được dung dịch có chứa 7,6 gam chất tan. Giá trị của x là
A. 1,2. B.0,8. C. 0,6. D. 0,5.
Đáp án: D
nNaOH = 0,1 mol.
Nếu NaOH hết ⇒ mNaNO3 = 0,1. 85 = 8,5g < 7,6 gam chất tan => loại
nHNO3 = 0,1x = nNaOH pư = nNaNO3
⇒ mchất tan = mNaNO3 + mNaOH dư
⇒ 0,1x. 85 + (0,1 – 0,1x). 40 = 7,6
⇒ x = 0,8
Bài 10: Trung hòa 100 gam dung dịch A chứa hỗn hợp HCl và H2SO4 cần vừa đủ 100 ml dung dịch B chứa NaOH 0,8M và Ba(OH)2 0,6M thu được 11,65 gam kết tủa. Nồng độ phần trăm của HCl trong dung dịch A là
A. 7,30% B. 5,84% C. 5,00% D. 3,65%
Đáp án: D
Đặt số mol HCl và H2SO4 lần lượt là x và y
Phản ứng trung hòa: H+ + OH- → H2O
Phản ứng tạo kết tủa: Ba2+ + SO42- → BaSO4
Ta có: nH+ = nOH- ⇒ x + 2y = 0,2
nBaSO4 = 0,05 mol, nBa(OH)2 = 0,06 mol
⇒ Ba2+ dư sau phản ứng, SO42- đã kết tủa hết
⇒ y = nBaSO4 ⇒ x = 0,1 mol
CHCl = 0,1.36.5 / 100 = 3,56%
Bài 11: Axít nào sau đây là axit một nấc?
A. H2SO4 B. H2CO3 C. CH3COOH D. H3PO4
Đáp án: C
Bài 12: Dãy chất nào sau đây chỉ gồm các hiđrôxit lưỡng tính ?
A. Al(OH)3, Zn(OH)3, Fe(OH)2 B. Zn(OH)2, Sn(OH)2, Pb(OH)2
C. Al(OH)3, Fe(OH)2,Cu(OH)2 D. Mg(OH), Pb(OH)2, Cu(OH)2
Đáp án: B
Bài 13: Cho các dung dịch axit có cùng nồng độ mol: H2S,HCl, H2SO4, H3PO4, dung dịch có nồng độ H lớn nhất là
A. H2SO4 B. H2S C. HCl D. H3PO4
Đáp án: A
Bài 14: Theo thuyết Areniut, kết luận nào sau đây đúng?
A. Bazơ là chất khi tan trong nước phân li cho anion OH.
B. Bazơ là những chất có khả năng phản ứng với axit.
C. Một Bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
D. Bazơ là hợp chất trong thành phần phân tử có một hay nhiều nhóm OH.
Đáp án: A
Bài 15: Theo thuyết Areniut kết luận nào sau đây không đúng?
A. Muối là những hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
B. Muối axit là muối mà anion gốc axit vẫn còn hiđrô có khả năng phân li ra ion H+.
C. Muối trung hòa là muối mà anion gốc axit không còn hiđrô có khả năng phân li ra H+.
D. Hiđrôxít lưỡng tính khi tan vào nước vừa có thể phân li như axit vừa có thể phân li như Bazơ.
Đáp án: A
Trắc nghiệm Sự điện li của nước. pH. Chất chỉ thị axit - bazơ có đáp án – Hóa học lớp 11
Bài 1: Dung dịch có pH = 7 là:
A. NH4Cl. B. CH3COONa.
C. C6H5ONa. D. KClO3.
Đáp án: D
Bài 2: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. NaCl. B. NH4Cl.
C. Na2CO3. D. FeCl3.
Đáp án: C
Bài 3: Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng) ?
A. CH3COOH, HCl và BaCl2.
B. NaOH, Na2CO3 và Na2SO3.
C. H2SO4, NaHCO3 và AlCl3.
D. NaHSO4, HCl và AlCl3.
Đáp án: D
Bài 4: Cho các dung dịch muối: Na2CO3 (1), NaNO3 (2), NaNO2 (3), NaCl (4), Na2SO4 (5), CH3COONa (6), NH4HSO4 (7), Na2S (8). Những dung dịch muối làm quỳ hoá xanh là :
A. (1), (2), (3), (4). B. (1), (3), (5), (6).
C. (1), (3), (6), (8). D. (2), (5), (6), (7).
Đáp án: C
(2) (4) (5): trung tính
(7): axit
Bài 5: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là :
A. NaNO3; KCl.
B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3.
D. NaNO3; K2CO3; CuSO4.
Đáp án: A
K2CO3: Bazơ
CuSO4, FeCl3, FeCl2: Axit
Bài 6: Chọn câu trả lời đúng, khi nói về muối axit :
A. Dung dịch muối có pH < 7.
B. Muối cố khả năng phản ứng với bazơ.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối mà gốc axit vẫn còn hiđro có khả năng phân li tạo proton trong nước.
Đáp án: D
Bài 7: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
A. 10 ml. B. 15 ml. C. 20 ml. D. 25 ml.
Đáp án: C
H+ + OH- → H2O
Ta có: ⇒ V = 20 ml.
Bài 8: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl- và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml. B. 300 ml. C. 200 ml. D. 250 ml.
Đáp án: A
Khi thêm K2CO3 vào dung dịch A, khi lượng kết tủa thu được là lớn nhất tức là toàn bộ Mg2+, Ba2+, Ca2+ đã kết tủa, trong dung dịch còn lại KCl và KNO3
⇒ nK+ = nCl- + nNO3- = 0,3 mol
⇒ nK2CO3 = 0,15 mol
⇒ VK2CO3 = 150 ml
Bài 9: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330 B. 0,10 và 6,990.
C.0,10 và 4,660 D. 0.05 và 3,495
Đáp án: D
Sau phản ứng trung hòa pH = 1 ⇒ H+ dư
H+ + OH- → H2O
nH+bd = 0,08 mol; sau phản ứng pH = 1
⇒ nH+ sau p/ư = 0,05 mol
nH+p/ư = nOH- = 0,03 mol
⇒ nBa(OH)2 = 0,015 mol
⇒ CM Ba(HCO3)2 = 0,05 (mol/l)
nBaSO4 = nBa(OH)2 = 0,015 mol (H2SO4 dư) ⇒ mBaSO4 = 3,495g
Bài 10: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
A. 134. B. 147. C. 114. D. 169.
Đáp án: A
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1M 100 ml HNO3 0,2M và 100 ml HCl 0,3M trộn lại với nhau. Vậy:
Phản ứng của dung dịch A và B là: H+ + OH- → H2O
nH+ p/ư = nOH- = 0,049.0,001V ⇒ nH+ p/ư = 0,01 (0,3 + 0,001V)
⇒ 0,07 = 0,49.0,001V + 0,010,3 + 0,001V) ⇒ V = 134 ml
Bài 11:Trộn V1 ml dung dịch NaOH có pH = 13 với V2 ml dung dịch Ba(OH)2 có pH = 11, thu được dung dịch mới có pH = 12. Tỉ số V1 : V2 có giá trị là
A. 1/1 B. 2/1 C. 1/10 D. 10/1
Đáp án: C
Ban đầu nOH- = 0,1. V1 + 0,002. V2
pH = 12 ⇒
⇒ V1 : V2 = 1/10
Bài 12: Trộn V1 lít dung dịch H2SO4 có pH = 3 với 2 lít dung dịch NaOH có pH = 12, thu được dung dịch mới cố pH = 4. Tỉ số V1 : V2 có giá trị là
A. 8/1 B. 101/9 C. 10/1 D. 4/1
Đáp án: B
Ban đầu nH+ = 0,001.V1; nOH- = 0,01.V2
Dung dịch sau có: pH = 4 ⇒
⇒ V1 : V2 = 101/9
Bài 13: Trộn hai dung dịch Ba(HCO3)2 và NaHSO4 có cùng nồng độ mol với nhau theo tỉ lệ thể tích 1 : 1 thu được kết tủa và dung dịch và dung dịch . Bỏ qua sự thủy phân của các ion và sự điện li của nước, các ion cos mặt trong dung dịch Y là
A. Na+ và SO42- B. Ba2+ ,HCO32- và Na+
C. Na+ , HCO32- D. Na+ , HCO32- và SO42-
Đáp án: C
Bài 14: Cho các dung dịch HCl, H2SO4 và CH3COOH có cùng giá trị pH. Sự sqps xếp nào sau đây đúng với giá trị nồng độ mol của các dung dịch trên ?
A. HCl < H2SO4 < CH3COOH
B. H2SO4 < HCl < CH3COOH
C. H2SO4 < CH3COOH < HCl
D. CH3COOH < HCl < H2SO4
Đáp án: B
Bài 15: Chỉ dùng quỳ tím , có thể nhận biết ba dung dịch riêng biệt nào sau đây ?
A. HCl, NaNO3, Ba(OH)2 B. H2SO4, HCl,KOH.
C. H2SO4, NaOH, KOH D. Ba(OH)2, NaCl, H2SO4
Đáp án: A
Trắc nghiệm Phản ứng trao đổi ion trong dung dịch các chất điện li có đáp án – Hóa học lớp 11
Bài 1: Cho dung dịch Fe2(SO4)3 phản ứng với dung dịch Na2CO3 thì sản phẩm tạo ra là:
A. Fe2(CO3)3 và Na2SO4
B. Na2SO4; CO2 và Fe(OH)3
C. Fe2O3; CO2; Na2SO4 và CO2
D. Fe(OH)3; CO2; Na2SO4; CO2
Đáp án: B
Fe2(SO4)3 + 3Na2CO3 → Fe2(CO3)3 + 3Na2SO4
Tuy nhiên Fe2(CO3)3 không bền bị thủy phân:
Fe2(CO3)3 + 3H2O → 2Fe(OH)3 + 3CO2
→ Fe2(SO4)3 + 3Na2CO3 + H2O → 2Fe(OH)3 + 3CO2 + 3Na2SO4
Bài 2: Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án: C
Bài 3: Các ion nào sau không thể cùng tồn tại trong một dung dịch
A. Na+, Mg2+, NO3-, SO42-.
B. Ba2+, Al3+, Cl-, HSO4-.
C. Cu2+, Fe3+, SO42-, Cl-.
D. K+, NH4+, OH-, PO43-.
Đáp án: B
Bài 4: Các ion có thể tồn tại trong cùng một dung dịch là:
A. Na+, NH4+, SO42-, Cl-.
B. Mg2+, Al3+, NO3-, CO32-.
C. Ag+, Mg2+, NO3-, Br-.
D. Fe2+, Ag+, NO3-, CH3COO-.
Đáp án: A
Bài 5: Dung dịch X có chứa 0,07 mol Na+, 0,02 mol SO42-, và x mol OH-. Dung dịch Y có chứa ClO4-, NO3- và y mol H+; tổng số mol ClO4-, NO3- là 0,04 mol. Trộn X và T được 100 ml dung dịch Z. Dung dịch Z có pH (bỏ qua sự điện li của H2O) là :
A. 1. B. 12.
C. 13. D. 2.
Đáp án: A
Áp dụng bảo toàn điện tích cho các dung dịch X và Y ta có:
1.nNa+ = 2.nSO42- + 1.nOH- ⇒ 0,07 = 0,02.2 + x ⇒ x = 0,03
1.nClO4- + 1.nNO3- = 1.nH+ ⇒ y = 0,04
Phương trình phản ứng:
H+ + OH- → H2O
⇒ nH+ dư = 0,01 ⇒ [H+] = 0,1 ⇒ pH = 1.
Bài 6: Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 6,72 lít khí (đktc) và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1. B. 31,7. C. 69,4. D. 64,0.
Đáp án: A
2H+ + CO32- → CO2 + H2O
nCl- = nH+ = 2nCO2 = 0,6 mol
m = mX – mCO32- + mCl- = 26,8 – 0,3.60 + 0,6.35,5 = 30,1 gam
Bài 7: Cho 47 gam K2O vào m gam dung dịch KOH 14%, thu được dung dịch KOH 21%. Giá trị của m là
A. 353. B. 659. C. 753. D. 800.
Đáp án: B
nK2O = 0,5 mol ⇒ nKOH tạo ra = 1 mol;
Dung dịch KOH 21% ⇒
⇒ m = 659 gam
Bài 8: Để pha được 1 lít dung dịch chứa Na2SO4 0,04M, K2SO4 0,05 M và KNO3 0,08M cần lấy
A. 12,15 gam K2SO4 và 10,2 gam NaNO3.
B. 8,08 gam KNO3 và 12,78 gam Na2SO4.
C. 15,66 gam K2SO4 và 6,8 gam NaNO3.
D. 9,09 gam KNO3 và 5,68 gam Na2SO4.
Đáp án: C
Trong 1 lít dung dịch cần pha có:
nNa+ = 0,08 mol, nK+ = 0,18 mol, nSO42- = 0,09 mol, nNO3- = 0,08 mol
⇒ Ban đầu có 0,08 mol NaNO3 và 0,09 mol K2SO4
⇒ Cần phải thêm lấy 6,8 gam NaNO3 và 15,66 gam K2SO4
Bài 9: Hòa tan một hỗn hợp 7,2 gam gồm hai muối sunfat của kim loại A và B vào nước được dung dịch X. Thêm vào dung dịch X môt lượng vừa đủ BaCl2 đã kết tủa ion SO42-, thu được 11,65 gam BaSO4 và dung dịch Y. Tổng khối lượng hai muối clorua trong dung dịch Y là
A. 5,95 gam. B. 6,5 gam.
C. 7,0 gam. D. 8,2 gam.
Đáp án: A
M2(SO4)n + nBaCl2 → 2MCln + nBaSO4
⇒ nBaSO4 = 0,05 mol = nBaCl2
Theo bảo toàn khối lượng: mM2(SO4)n + mBaCl2 = mMCln + mBaSO4
⇒ mMCln = 5,95g
Bài 10: Cho 1 lít dung dịch gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng với 43 gam hỗn hợp rắn Y gồm BaCl2 và CaCl2. Sau khi phản ứng kết thúc, thu được 39,7 gam kết tủa. Tỉ lệ khối lượng của BaCl2 trong Y là
A. 24,19%. B. 51,63%.
C. 75,81%. D. 48,37%
Đáp án: D
nBaCl2 = x mol; nCaCl2 = y mol
Y:
mgiảm = 42 - 39,7 = mCl- - mCO32-
⇒ 71(x + y) – 60(x + y) = 3,3 gam
x + y = 0,3 mol (1)
mkết tủa = 39,7 ⇒ 197x + 100y = 39,7 (2)
Từ (1)(2) ⇒ x = 0,1; y = 0,2
%m BaCl2 = [(208. 0,1)/43]. 100% = 48,37%
Bài 11: Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3
A. KBr B. K3PO4
C. HCl D. H3PO4
Đáp án: D
Bài 12: Cho dung dịch chứa các ion sau : Na+ ,Ca2+ ,Mg2+ ,Ba2+ , H+ , NO3-. Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng :
A. dung dịch K2CO3vừa đủ . B. dung dịch Na2SO4 vừa đủ.
C. dung dịch KOH vừa đủ. D. dung dịch Na2SO3 vừa đủ.
Đáp án: D
Bài 13: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch ?
A. AlCl3 và Na2CO3 B. HNO3 và NaHCO3
C. NaAlO2 và KOH D. NaCl và AgNO3
Đáp án: C
Bài 14: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + OH- → H2O ?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4
D. H2SO4 +Ba(OH)2 → 2 H2O + BaSO4
Đáp án: A
Bài 15: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau : Ba2+ ,Al3+ , Na+, Ag+ ,CO32 ,NO3- ,Cl- ,SO42- . Các dung dịch đó là :
A. BaCl2,Al2(SO4)3,Na2CO3,AgNO3.
B. Ba(NO3)2, Al2(SO4)3,Na2CO3, AgCl.
C. BaCl2, Al2(SO4)3,Na2CO3,AgNO3.
D. Ba(NO3)2, Al2(SO4)3,NaCl, Ag2CO3.
Đáp án: A
Trắc nghiệm Luyện tập: Axit, bazơ và muối, Phản ứng trao đổi ion trong dung dịch các chất điện li có đáp án – Hóa học lớp 11
Bài 1: Một dung dịch chứa a mol Na+ , 2 mol Ca2+ , 4 mol Cl , 2 mol HCO3- . Cô cạn dung dịch này ta được lượng chất rắn có khối lượng là
A. 390 gam. B. 436 gam. C. 328 gam D. 374 gam.
Đáp án: C
Áp dụng định luật bảo toàn điện tích: a + 2 = 4 + 2 => a = 4 mol
Cô cạn: 2HCO3- -toC→ CO32- + CO2 + H2O
nCO32- = 1/2. nHCO3- = 1 mol
mc/rắn = mNa+ + mCa2+ + mCl- + mCO32-
mc/rắn = 2.23 + 2.40 + 4.35,5 + 1.60 = 328 gam
Bài 2: Cho dung dịch X gồm 0,06 mol Na+, 0,01 mol K+ , 0,03 mol Ca2+ , 0,07 mol Cl- và 0,06 mol HCO3-. Để loại bỏ hết ion Ca2+ cần một lượng vừa đủ dùng dịch chứa a gam Ca(OH)2. Giá trị của a là
A. 1,80. B. 1,20 C. 2,22. D. 4,44.
Đáp án: C
HCO3- (0,06) + OH- (0,06) → CO32- (0,06 mol) + H2O
nCa(OH)2 = 0,03 mol ⇒ nCa2+ = 0,03 + 0,03 = 0,06 = nCO32- (vừa đủ)
a = 0,03. 74 = 2,22 gam
Bài 3: Cho dung dịch A chứa NaHCO3 xM và Na2CO3 yM. Lấy 10 ml dung dịch A tác dụng vừa đủ với 10 ml dung dịch NaOH 1M. Mặt khác , 5 ml dung dịch A tác dụng vừa hết với 10 ml dung dịch HCl 1M. giá trị của x và y lần lượt là
A. 1,0 và 0,5 B. 0,5 và 0,5
C. 1,0 và 1,0 D. 0,5 và 1,0.
Đáp án: A
Khi cho NaOH = 0,01 mol
HCO3- + OH- → CO32- + H2O
nHCO3- = nOH- = 0,01x = 0,01 ⇒ x = 1
Khi cho HCl = 0,01mol
H+ + HCO3- → CO2 + H2O
2H+ + CO32- → CO2 + H2O
nH+ = nHCO3- + 2nCO32-
⇒ 0,01 = 0,005x + 2.0,005y
⇒ y = 0,5
Bài 4: Dung dịch X chứa 0,4 mol HCl, dung dịch Y chứa 0,2 mol NaHCO3 và 0,3 mol Na2CO3. Nếu cho từ từ dung dịch X vào dung dịch Y thì thoát ra a mol khí . Nếu cho từ từ dung dịch Y vào dung dịch X thì thoát ra b mol khí. Giá trị của a và b lần lượt là
A. 0,10 và 0,50 B. 0,30 và 0,20
C. 0,20 và 0,30 D. 0,10 và 0,25
Đáp án: D
- Nếu cho từ từ HCl (X) vào dung dịch Y, phản ứng 1 và 2 sau đây sẽ xảy ra lần lượt:
HCl + Na2CO3 → NaHCO3 + NaCl 1
HCl + NaHCO3 → NaCl + H2O + CO2 2
Phản ứng 1: nNa2CO3 = nHCl p/u (1) = 0,3 mol
Phản ứng 2: nCO2 = nHCl p/u (2) = 0,4 - 0,3 = 0,1 mol
- Nếu cho từ từ Y vào dung dịch HCl (X): phản ứng 3 và 4 sau đây sẽ xảy ra đồng thời:
2HCl + Na2CO3 → NaCl + H2O + CO2 3
HCl + NaHCO3 → NaCl + H2O + CO2 4
Tỉ lệ số mol phản ứng là: nNaHCO3 : nNa2CO3 = 2 : 3
Đặt số mol NaHCO3 phản ứng là x thì số mol Na2CO3 phản ứng là 1,5x
Phản ứng 3: nHCl p/u (3) = 2nCO2= 3x
Phản ứng 4: nHCl p/u (4) = nNaHCO3 = x
Ta có: nHCl = 4x = 0,4 mol . Vậy x = 0,1 mol
nCO2 = 1,5x + x. Vậy nCO2 = 0,25 mol
Bài 5: Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch A gồm Na2CO3 xM và NaHCO3 yM thì thu được 1,008 lít khí (đktc) và dung dịch B. Cho dung dịch B tác dụng với dung dịch Ba(OH)2 dư thì thu được 29,55 gam kết tủa. Giá trị của x và y lần lượt là
A. 0,30 và 0,09 B. 0,21 và 0,18.
C. 0,09 và 0,30. D. 0,15 và 0,24.
Đáp án: B
Cho từ từ HCl vào dung dịch Na2CO3 và NaHCO3: phản ứng (1) và (2) sau đây xảy ra lần lượt:
HCl + Na2CO3 → NaHCO3 + NaCl (1)
HCl + NaHCO3 → NaCl + H2O + CO2 (2)
Phản ứng 1: nNa2CO3 = nHCl p/u(1) = 0,5x mol
Phản ứng 2: nCO2 = nHCl p/u (2) = 0,045 mol
Tổng số mol HCl: 0,5x + 0,045 = 0,15 ⇒ x = 0,21 mol
Theo định luật bảo toàn nguyên tố C: nNa2CO3 + nNaHCO3 = nCO2 + nBaCO3
Vậy: 0,5x + 0,5y = 0,045 + 0,15. Thay x = 0,21 tính ra y = 0,18.
Bài 6: Cho các phản ứng sau :
(1) NaHCO3 + NaOH → (2) NaHCO3 + KOH →
(3) Ba(OH)2 + Ba(HCO3)2 → (4) NaHCO3 + Ba(OH)2 →
(5) KHCO3 + NaOH → (6) Ba(HCO3)2 + NaOH →
Trong các phản ứng trên, số phản ứng có phương trình ion thu gọn HCO3- + OH → CO32- + H2O là
A. 3 B. 4 C. 5 D. 6
Đáp án: A
Phản ứng (1), (2), (5)
Bài 7: Cho các phản ứng sau :
(1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2
(3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3
(5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2
Trong các phản ứng trên, những phản ứng có cùng phương trình ion thu gọn là
A. (2), (3), (4), (6). B. (1), (3), (5), (6).
B. (1), (2), (3), (6). D. (3), (4), (5), (6).
Đáp án: C
Bài 8: Trộn 100 ml dung dịch HCl có pH = 1 với 100 ml dung dịch gồm KOH 0,1m và NaOH aM, thu được 200 ml dung dịch có pH = 12. Giá trị của a là
A. 0,12 B. 0.08. C. 0,02. D. 0,10.
Đáp án: C
Sau phản ứng pH = 12 ⇒ OH- dư
COH- dư = 10-2 ⇒ nOH- dư = 0,01 . 0,2 = 0,002 (mol)
Phản ứng: H+ + OH- → H2O
Vậy nOH- bd = 0,01 + 0,002 = 0,012 (mol)
COH- bd = 0,012 / 0,1 = 0,12 (M) ⇒ CM(NaOH) = 0,02 M
Bài 9: Cho từ từ 200 ml dung dịch HCl 1,0M vào 200 ml dung dịch chứa NaHCO3 và Na2CO3 thu được 1,12 lít CO2 (đktc). Nồng độ của Na2CO3 là
A. 0,5M B. 1,25M C. 0,75M D. 1,5M
Đáp án: C
Phản ứng: 1 HCl + Na2CO3 → NaHCO3 + NaCl
2 HCl + NaHCO3 → NaCl + H2O + CO2
Xét phản ứng 2: nCO2 = nHCl (p/ư 1)= 0,02 - 0,05 = 0,15 mol
Vậy: CM (Na2CO3) = 0,15/0,2 = 0,75 (M)
Bài 10: Sục V lít khí CO2 (đktc) vào 200 ml dung dịch Na2CO3 1M thu dược dung dịch X chứa hai muối. Cho nước vôi trong dư vào dung dịch X, thu dược 35 gam kết tửa. Giá trị của V là
A. 2,240. B. 3,136. C. 2,800. D. 3,360.
Đáp án: D
Phản ứng: 1 CO2 + H2O + Na2CO3 → 2NaHCO3
2 Ca(OH)2 + NaHCO3 → CaCO3 ↓ + NaOH + H2O
3 Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Nhận xét: C trong CO2 và NaCO3 ban đầu đều chuyển thành kết tủa CaCO3.
Vậy: nCaCO3 = nCO2 + nNa2CO3
⇒ 0,35 = nCO2 + 0,2
Tính ra nCO2 = 0,15. VCO2 = 3.36 lít
Bài 11: Dãy ion nào sau đây chứa các ion đều phản ứng được với ion OH ?
A. H+, NH4+ ,HCO3- ,CO32-
B. Fe2+, Zn2+, HSO4- . SO32-
C. Ba2+, Mg2+, Al,PO43-
D. Fe3+, Cu2+, Pb2+, HS
Đáp án: D
Bài 12: Ion CO không tác dụng với tất cả các ion thuộc dãy nào sau đây ?
A. NH4+, K+, Na+
B. H+, NH4+, K+, Na+
C. Ca2+, Mg2+, Na+
D. Ba2+, Cu2+, NH4+, K+
Đáp án: A
Bài 13: Dung dịch A có a mol NH4+ , b mol Mg2+ , c mol SO42- và d mol HSO3- . Biểu thức nào dưới đây biểu thị đúng sự liên quan giữa a, b, c, d ?
A. a + 2b = c + d B. a + 2b = 2c + d
C. a + b = 2c + d D. a + b = c + d
Đáp án: B
Bài 14: Dãy nào sau đây gồm các chất vừa tác dụng được với dung dịch axit,vừa tác dụng với dung dịch bazơ ?
A. Al(OH)3, (NH4)2CO3, NH4Cl
B. NaOH ,ZnCl2 ,Al2O3
C. KHCO3, Zn(OH)2 CH3COONH4
D. Ba(HCO3)2 ,FeO , NaHCO3
Bài 15: Cho các nhóm ion sau :
(1) Na+ , Cu2+, Cl ,OH (2) K+ ,Fe2+ ,Cl , SO42- .
(3) K+ ,Ba2+ ,Cl , SO42- (4) HCl3- , Na+ , K+ , HSO4-
Trong các nhóm trên,những nhóm tồn tại trong cùng một dung dịch là
A. (1),(2),(3),(4). B. (2), (3).
C.(2), (4). D. (2).
Đáp án: D
Bài 16: Hốn hợp X chứa K2O , NH4Cl , KHCO3 , BaCl2 có số mol bằng nhau. Cho hỗn hợp X vào nước (dư), đun nóng , thu được dung dịch chứa chất tan là
A. KCl, KOH B. KCl
C. KCl , KHCO3 , BaCl2 D. KCl , KOH , BaCl2
Đáp án: B
Trắc nghiệm Tính axit, bazơ có đáp án – Hóa học lớp 11
Bài 1: Cấu hình electron nguyên tử của nitơ là
A. 1s22s22p1. B. 1s22s22p5.
C. 1s22s22p63s23p2. D. 1s22s22p3.
Đáp án: D
Bài 2: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với ôxi tạo ra hợp chất X. Công thức của X là
A. N2O. B. NO2. C. NO. D. N2O5.
Đáp án: C
Bài 3: Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây ?
A. H2. B. O2. C. Mg. D. Al.
Đáp án: B
Bài 4: Có thể thu được nitơ từ phản ứng nào sau đây ?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Đáp án: A
Bài 5: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2 có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kemms hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Đáp án: A
Bài 6: Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
A. 37,5%. B. 25,0%. C. 50%. D. 75%.
Đáp án: D
Trong bình phản ứng cùng thể tích nhiệt độ do đó áp suất tỉ lệ với số mol, áp suất bình giảm 5% so với ban đầu ⇒ nN2 pư = 5% ban đầu = 0,05 mol
3Mg + N2 -toC→ Mg3N2
nMg = 3nN2 = 0,15
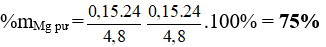
Bài 7: Hỗn hợp N2 và H2 trong bình phản ứng ở nhiệt độ không đổi. Sau thời gian phản ứng, áp suất các khí trong bình thay đổi 5% so với áp suất ban đầu. biết rằng số mol N2 đã phản ứng là 10%. Thành phần phần trăm số mol N2 trong hỗn hợp ban đầu là
A. 20%. B. 25%. C. 10%. D. 5%.
Đáp án: D
N2 + 3H2 -toC→ 2NH3
Áp suất thay đổi 5% so với áp suất ban đầu
Giả sử trước phản ứng có 1 mol ⇒ sau phản ứng có 0,95 mol
ntrước – nsau = 2nN2 pư = 0,05 mol
nN2 ban đầu = 0,025 : 10% = 0,25 ⇒ %nN2 = 25%
Bài 8: Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn sô với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
A. 10%. B. 20%. C. 25%. D. 5%.
Đáp án: C
MX = 4.1,8 = 7,2
Xét 1 mol hỗn hợp gồm a mol N2 và b mol H2:
a + b = 1; 28a + 2b = 7,2 ⇒ a = 0,2; b = 0,8 (mol)
N2 + 3H2 → 2NH3
nY = 1 – 2a
Mà MY = 4.2 = 8; mY = mX = 7,2 ⇒ nY = 0,9 = 1 – 2a
⇒ a = 0,05 (mol). Vậy H = (0,05/0,2). 100% = 25%
Bài 9: Người ta sản xuất khi nitơ trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2 bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng
Đáp án: A
Bài 10: Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Đáp án: D
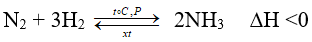
Chiều thuận của phản ứng có tổng số mol khí giảm ⇒ muốn tăng hiệu suất thì tăng áp suất
Chiều thuận của phản ứng là chiều tỏa nhiệt ⇒ tăng hiệu suất thì giảm nhiệt độ
Bài 11: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. nhiệt phân NaNO2
B. Đun hỗn hợp NaNO2 và NH4Cl
C. thủy phân Mg3N2
D. phân hủy khí NH3
Đáp án: B
Bài 12: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2 + 3H2 → 2NH3
B. N2 + 6Li → 2Li3N
C. N2 + O2 → 2NO
D. N2 + 3Mg → Mg3N2
Đáp án: C
Bài 13: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2
B. Al, H2 và Mg
C. NaOH, H2 và Cl2
D. HI, O3 và Mg
Đáp án: B
Bài 14: Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
A. 15,12 B. 18,23
C. 14,76 D. 13,48
Đáp án: C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
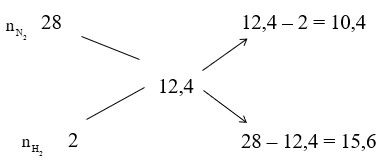
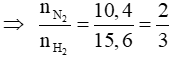
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên: nY = nX - 0,8 = 2 + 3 - 0,8 = 4,2 mol
Theo định luật bảo toàn khối lượng ta có: mY = mX = mN2 + mH2 = 2.28 + 3.2 = 62 gam
Vậy
Bài 15: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
A. 1.278 B. 3,125
C. 4.125 D. 6,75
Đáp án: B
Theo giả thiết ta thấy ban đầu [H2] = [N2] = 1M.
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng [NH3] = 0,4M
Phương trình phản ứng hoá học :
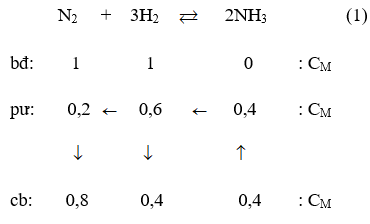
Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] = 0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :