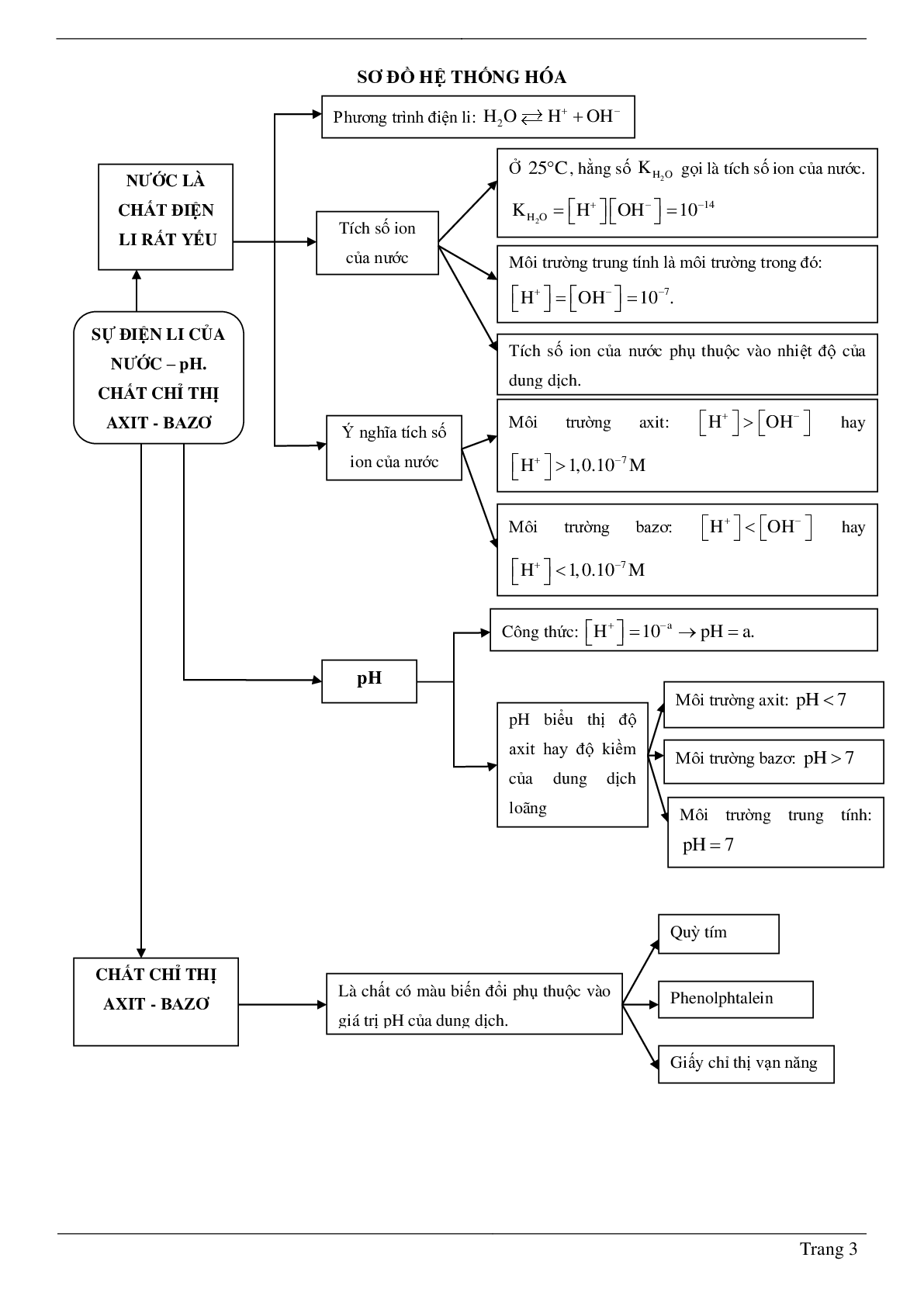Tailieumoi.vn sưu tầm và biên soạn chuyên đề Sự điện li của nước. pH. Chất chỉ thị axit-bazơ gồm đầy đủ lý thuyết, các dạng bài tập chọn lọc và ví dụ minh họa từ cơ bản đến nâng cao giúp học sinh ôn luyện kiến thức, biết cách làm bài tập môn Hóa học 11.
Chuyên đề Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
I. LÍ THUYẾT TRỌNG TÂM
1. Nước là chất điện li rất yếu
a. Sự điện li của nước
Nước là chất điện rất yếu.
Phương trình điện li:
b. Tích số ion của nước
Ở , hằng số gọi là tích số ion của nước.
là hằng số cân bằng ở nhiệt độ xác định gọi là tích số ion của nước.
Ở :
Nước là môi trường trung tính, nên môi trường trung tính là môi trường trong đó .
c. Ý nghĩa tích số ion của nước
Trong môi trường axit:
Môi trường axit:
Ví dụ: Tính và của dung dịch HCl .
Phương trình điện li
M
.
Trong môi trường bazơ:
Môi trường bazơ:
Ví dụ: Tính và của dung dịch NaOH .
Phương trình điện li:
M
hay
Vậy là đại lượng đánh giá độ axit, độ bazơ của dung dịch.
Môi trường trung tính:
Môi trường bazơ:
Môi trường axit:
2. Khái niệm về pH, chất chỉ thị axit – bazơ
a. Khái niệm pH
hay
Nếu
Để tránh ghi giá trị với số mũ âm, người ta dùng pH.
Ví dụ:
: môi trường axit.
: môi trường bazơ.
: môi trường trung tính.
b. Chất chỉ thị axit – bazơ
Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tìm, phenolphtalein, chỉ thị vạn năng. Những chất như quỳ tím, phenolphtalenin có màu biến đổi phụ thuộc vào giá trị pH của dung dịch là chất chỉ thị axit-bazơ.
II. CÁC DẠNG BÀI TẬP
Dạng 1: Bài tâp lí thuyết định tính
Kiểu hỏi 1: Nhận biết dung dịch có tính axit, bazơ, trung tính
Phương pháp giải
Môi trường axit:
Môi trường bazơ:
Môi trường trung tính
Ví dụ: Cho các dung dịch: H2SO4, NH3, KNO3, KOH, Ba(NO3)2, Ca(OH)2, NaCl. Số dung dịch có là
A. 2. B. 3.
C. 4. D. 5.
Hướng dẫn giải
H2SO4 là axit mạnh, có môi trường axit nên
NH3, KOH, Ca(OH)2 là các bazơ, có môi trường bazơ nên
KNO3, Ba(NO3)2, NaCl là các muối trung hòa, có môi trường trung tính nên
Chọn B.
Ví dụ mẫu
Ví dụ 1: Cho các dung dịch: Na2SO4, HCl, KNO3, NaOH, Cu(NO3)2, Ca(OH)2, KCl.
Số dung dịch có pH > 7 là
A. 2. B. 4.
C. 3. D. 5.
Hướng dẫn giải
HCl là axit mạnh, có môi trường axit nên pH < 7
NaOH, Ca(OH)2 là các bazơ mạnh, có môi trường bazơ nên pH > 7
Na2SO4, KNO3, KCl là các muối trung hòa, có môi trường trung tính nên pH = 7
Vậy có 2 dung dịch có pH > 7
Chọn A.
Kiểu hỏi 2: So sánh pH của các dung dịch
Phương pháp giải
Axit: pH < 7
Axit càng mạnh pH càng nhỏ.
Axit càng yếu pH càng lớn.
Muối trung tính: pH = 7
Bazơ: pH > 7
Bazơ càng mạnh pH càng lớn.
Bazơ càng yếu pH càng nhỏ.
Ví dụ: Cho các dung dịch có cùng nồng độ mol sau:
HNO3, NaCl, NH3, CH3COOH, KOH. Dãy sắp xếp các dung dịch theo thứ tự pH tăng dần là:
A. HNO3, CH3COOH, NH3, NaCl, KOH.
B. HNO3, NH3, NaCl, CH3COOH, KOH.
C. HNO3, NaCl, NH3, CH3COOH, KOH.
D. HNO3, CH3COOH, NaCl, NH3, KOH.
Hướng dẫn giải
Nhận thấy:
HNO3: axit mạnh.
CH3COOH: axit yếu.
NaCl: muối có môi trường trung tính.
NH3: bazơ yếu.
KOH: bazơ mạnh.
Vậy dãy sắp xếp theo thứ tự pH tăng dần là:
HNO3, CH3COOH, NaCl, NH3, KOH.
Chọn D.
Ví dụ mẫu
Ví dụ 1: Cho các dung dịch có cùng nồng độ mol sau: H2SO4, NH3, KNO3, KOH, Ba(NO3)2, NaCl, CH3COOH. Dãy sắp xếp các dung dịch theo thứ tự pH giảm dần là:
A. H2SO4, NH3, KNO3, KOH, Ba(NO3)2.
B. NH3, KNO3, KOH, Ba(NO3)2, NaCl.
C. KOH, NH3, NaCl, CH3COOH, H2SO4.
D. KNO3, KOH, Ba(NO3)2, NaCl, CH3COOH.
Hướng dẫn giải
Nhận thấy:
H2SO4: axit mạnh.
CH3COOH: axit yếu.
NaCl, Ba(NO3)2: muối có môi trường trung tính.
NH3: bazơ yếu.
KOH: bazơ mạnh.
Vậy dãy sắp xếp theo thứ tự pH giảm dần là:
KOH, NH3, NaCl, CH3COOH, H2SO4.
Chọn C.
III. Bài tập tự luyện dạng 1
Câu 1: Công thức nào sau đây sai?
A. B.
C. D.
Câu 2: Ba dung dịch axit sau có cùng nồng độ mol: HCl, H2SO4, CH3COOH. Dãy sắp xếp giá trị pH của dung dịch theo thứ tự tăng dần là
A. HCl, H2SO4, CH3COOH. B. CH3COOH, HCl, H2SO4.
C. H2SO4, HCl, CH3COOH. D. HCl, CH3COOH, H2SO4.
Câu 3: Dung dịch CH3COOH 0,1M có và dung dịch HCl 0,1M có Phát biểu đúng là
A. a < b = 1 B. a > b = 1
C. a = b = 1 D. a = b > 1
Câu 4: Dung dịch có là
A. Ba(OH)2. B. HClO4.
C. HF. D. KNO3.
Dạng 2: Tính pH của dung dịch axit mạnh, bazơ mạnh
Phương pháp giải
Bước 1: Tính số mol các chất ban đầu.
Bước 2: Viết phương trình điện li (hoặc phương trình phản ứng).
Bước 3: Từ số mol các chất ban đầu và dựa vào phương trình điện li, tính tổng số mol , sau đó tính nồng độ
Chú ý: Tính lại thể tích dung dịch sau khi trộn (hoặc sau phản ứng).
Nếu đề bài đã cho thì bỏ qua bước này.
Bước 4: Tính pH của dung dịch theo công thức
Ví dụ: Hòa tan hoàn toàn 20 ml dung dịch HCl 0,05M vào 20 ml dung dịch H2SO4 0,075M. Tính pH của dung dịch mới biết không có sự hao hụt thể tích khi pha trộn.
Hướng dẫn giải
Phương trình điện li:
Thể tích dung dịch sau khi trộn bằng:
lít
Ví dụ mẫu
Ví dụ 1: Hòa tan 4,9 gam H2SO4 vào nước thu được 1 lít dung dịch. Tính pH của dung dịch thu được.
Hướng dẫn giải
Phương trình điện li:
M
Ví dụ 2: Trộn 100 ml dung dịch H2SO4 0,1M với 150 ml dung dịch NaOH 0,2M. Tính pH của dung dịch tạo thành.
Hướng dẫn giải
Phương trình hóa học:
Ban đầu: mol
Phản ứng: mol
Sau phản ứng: mol
Thể tích dung dịch sau phản ứng bằng: lít
Ta có:
IV. Bài tập tự luyện dạng 2
Bài tập cơ bản
Câu 1: Dung dịch H2SO4 0,005M có
A. B.
C. D.
Câu 2: pH của hỗn hợp dung dịch HCl 0,0050M và H2SO4 0,0025M là
A. 3. B. 2.
C. 4. D. 12.
Câu 3: Số ml dung dịch NaOH có cần để trung hòa 10 ml dung dịch HCl có là
A. 12 ml. B. 10 ml.
C. 100 ml. D. 1 ml.
Câu 4: Một dung dịch có thì nồng độ mol của ion là
A. 0,2M. B. 4,0M.
C. 0,4M. D.
Câu 5: Một dung dịch có pH của dung dịch là
A. 3,000. B. 4,000.
C. 0,003. D. 0,001.
Bài tập nâng cao
Câu 6: Trong các dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M với các thể tích bằng nhau, thu được 300 ml dung dịch A. Cho dung dịch A thu được tác dụng với V ml dung dịch NaOH 0,2M và KOH 0,29M thu được dung dịch có Giá trị của V là
A. 169. B. 147.
C. 134. D. 414.
Câu 7: Trộn 100 ml dung dịch có gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a mol/l thu được 200 ml dung dịch có Giá trị của a là
A. 0,03. B. 0,30.
C. 0,15. D. 0,12.
Câu 8: Hòa tan 3,66 gam hỗn hợp Na, Ba vào nước dư thu được 800 ml dung dịch A và 0,896 lít H2 (đktc). pH của dung dịch A là
A. 3. B. 12
C. 1. D. 13.
Câu 9: Cho 10 ml dung dịch HCl có pH = 3. Cần thêm vào dung dịch này bao nhiêu ml nước để thu được dung dịch có pH = 4?
A. 1 ml. B. 90 ml.
C. 10 ml. D. 100 ml.
Dạng 3: Nhận biết dung dịch bằng chỉ thị axit – bazơ
Ví dụ mẫu
Ví dụ 1: Chỉ dùng một thuốc thử nhận biết các dung dịch mất nhãn sau: H2SO4, KCl, Na2SO4, HNO3, Ba(OH)2.
Hướng dẫn giải
Dùng quỳ tím:
Na2SO4, KCl: Muối trung tính nên quỳ tím không đổi màu.
H2SO4, HNO3: Axit nên quỳ tím đổi màu đỏ.
Ba(OH)2: Bazơ nên quỳ tím đổi màu xanh.
Dùng Ba(OH)2 nhận biết các dung dịch còn lại.
|
|
H2SO4 |
HNO3 |
Na2SO4 |
KCl |
|
Ba(OH)2 |
trắng |
Không hiện tượng |
trắng |
Không hiện tượng |
Phương trình hóa học:
V. Bài tập tự luyện dạng 3
Câu 1: Bằng phương pháp hóa học, hãy nhận biết các dung dịch sau: NaOH, HNO3, KCl.
Câu 2: Chỉ dùng thêm một thuốc thử, hãy nhận biết các dung dịch không màu đựng trong các lọ mất nhãn sau: H2SO4, HCl, Ba(OH)2, KOH, NaCl.
Đáp án và lời giải
Dạng 1: Bài tập lí thuyết định tính
|
1 – A |
2 – C |
3 – B |
4 – D |
Dạng 2: Tính pH của dung dịch axit mạnh, bazơ mạnh
Câu 1: Chọn A.
Câu 2: Chọn B.
Câu 3: Chọn C.
Lại có:
Câu 4: Chọn D.
Câu 5: Chọn A.
Câu 6: Chọn C.
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1M 100 ml HNO3 0,2M và 100 ml HCl 0,3M trộn lại với nhau.
mol
Ta có:
Lại có: ml
Câu 7: Chọn D.
Dung dịch axit ban đầu có
Dung dịch sau phản ứng có nên bazơ dư và
Ta có:
Câu 8: Chọn D.
Gọi số mol của Na và Ba lần lượt là x, y mol.
Dựa vào khối lượng hỗn hợp và số mol H2, ta có:
Câu 9: Chọn B.
Dung dịch có
Dung dịch có pH = 4 có số mol H+ không đổi
Dạng 3: Nhận biết dung dịch bằng chỉ thị axit – bazơ
Câu 1: Dùng quỳ tím.
Câu 2:
Dùng quỳ tím để phân biệt ba nhóm: Nhóm I: quỳ chuyển đỏ (H2SO4, HCl); nhóm II: quỳ chuyển xanh (Ba(OH)2, KOH) và quỳ không chuyển màu (NaCl). Sau đó cho từng chất nhóm I và II phản ứng với nhau để nhận biết H2SO4 và Ba(OH)2, còn lại là HCl và KOH.