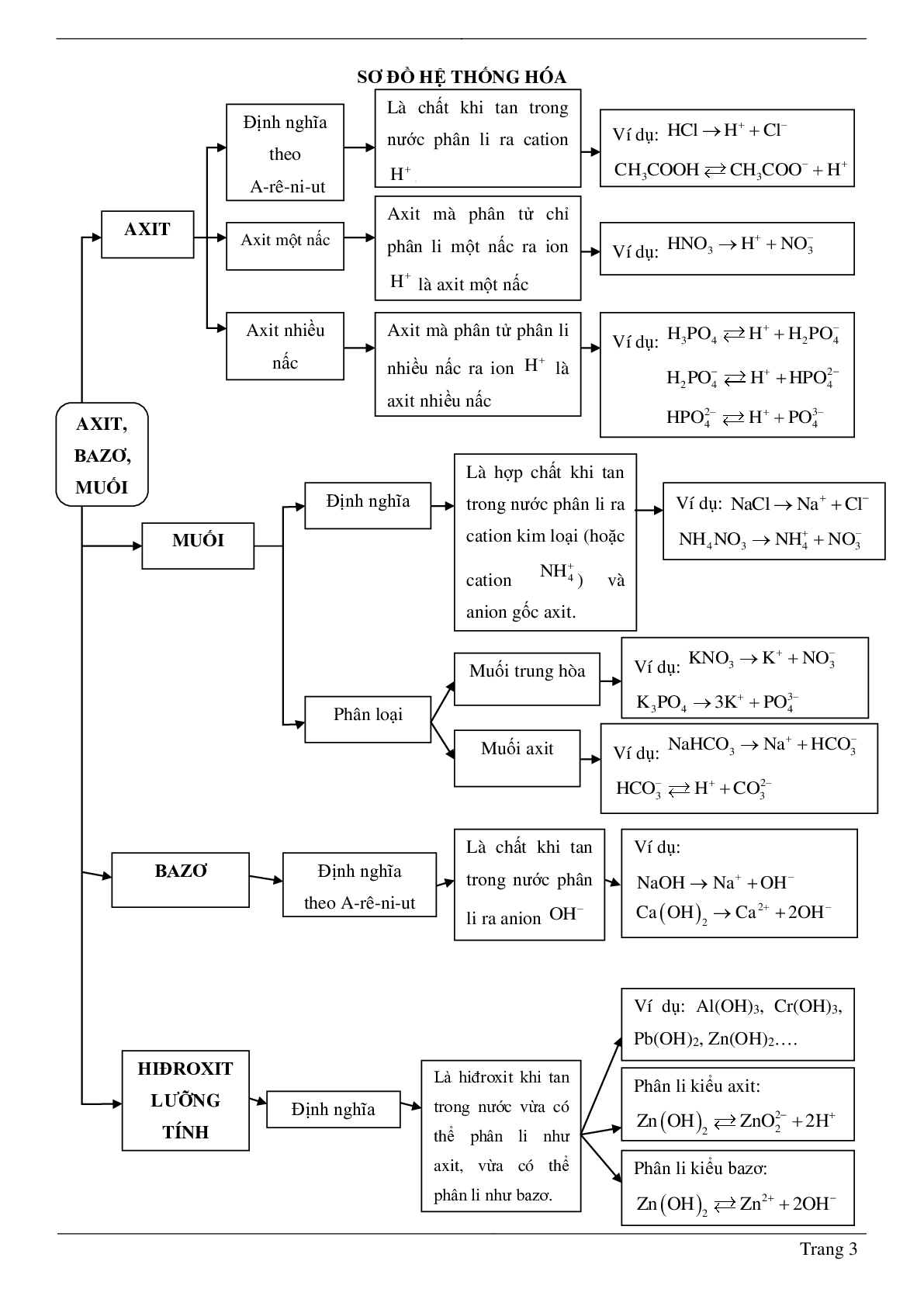Tailieumoi.vn sưu tầm và biên soạn chuyên đề Axit - Bazo - muối gồm đầy đủ lý thuyết, các dạng bài tập chọn lọc và ví dụ minh họa từ cơ bản đến nâng cao giúp học sinh ôn luyện kiến thức, biết cách làm bài tập môn Hóa học 11.
Chuyên đề Axit - Bazo - muối
I. LÍ THUYẾT TRỌNG TÂM
1. Axit
a. Định nghĩa
Theo thuyết A-rê-ni-ut:
Axit là chất khi tan trong nước phân li ra cation .
Khái niệm về axit đã học ở các lớp dưới: Phân tử axit gồm có một hay nhiều nguyên tử H liên kết với gốc axit. Các nguyên tử H này có thể thay thế bằng các nguyên tử kim loại.
Ví dụ: HCl, CH3COOH, HNO3… là các axit.
Ví dụ:
b. Axit một nấc và axit nhiều nấc
Axit mà khi tan trong nước, phân tử chỉ phân li một nấc ra ion là axit một nấc.
Axit mà khi tan trong nước, phân tử phân li nhiều nấc ra ion là axit nhiều nấc.
Chú ý: Đối với axit mạnh và bazơ mạnh nhiều nấc thì chỉ có nấc thứ nhất điện li hoàn toàn.
Ví dụ: Axit photphoric H3PO4
2. Bazơ
Theo thuyết A-rê-ni-ut:
Bazơ là chất khi tan trong nước phân li ra anion
Khái niệm về bazơ đã học ở lớp dưới: Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (OH).
Ví dụ:
3. Hiđroxit lưỡng tính
a. Định nghĩa
Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Ví dụ: Zn(OH)2 là hiđroxit lưỡng tính.
Phân li kiểu bazơ:
Phân li kiểu axit:
b. Đặc tính
Hiđroxit lưỡng tính thường gặp: Al(OH)3, Cr(OH)3, Pb(OH)2…ít tan trong nước.
Lực axit và bazơ của chúng đều yếu.
4. Muối
a. Định nghĩa
Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc cation ) và anion gốc axit.
Khái niệm về muối đã học ở lớp dưới: Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
b. Phân loại
Muối trung hòa: Muối mà anion gốc axit không còn hiđro có khả năng phân li ra ion .
Ví dụ: NaCl, Na2SO4, Na2CO3,…
Muối axit: Muối mà anion gốc axit vẫn còn hiđro có khả năng phân li ra ion .
Ví dụ: NaHCO3, NaH2PO4,…
c. Sự điện li của muối trong nước
Hầu hết muối tan đều phân li mạnh.
Nếu gốc axit còn chứa H có tính axit thì gốc này phân li yếu ra
Ví dụ:
Chú ý: Những muối được coi là không tan thì thực tế vẫn tan một lượng rất nhỏ, phần nhỏ đó điện li. Ví dụ: AgCl, BaSO4, CaCO3,…
II. CÁC DẠNG BÀI TẬP
Dạng 1: Câu hỏi lí thuyết về axit, bazơ, muối và viết phương trình điện li của các chất (nếu có)
Phương pháp giải
Axit là chất khi tan trong nước phân li ra và gốc axit.
Muối là chất khi tan trong nước phân li ra cation kim loại (hoặc cation ) và anion gốc axit.
Bazơ là chất khi tan trong nước phân li ra và cation kim loại.
Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Chú ý:
Khi viết phương trình điện li của chất điện li mạnh, sử dụng mũi tên một chiều.
Khi viết phương trình điện li của chất điện li yếu, sử dụng mũi tên hai chiều.
Ví dụ: Cho các chất sau: NaCl, Cl2, NaOH, MgCO3, H2CO3, Fe(OH)3, HNO3, FeO. Chất nào là axit, bazơ, muối? Viết phương trình điện li của các chất đó (nếu có).
Hướng dẫn giải
Các chất là axit: HNO3, H2CO3.
Các chất là muối: NaCl, MgCO3.
Các chất là bazơ: NaOH, Fe(OH)3.
Ví dụ mẫu
Ví dụ 1: Viết phương trình điện li của các chất Al(OH)3, Zn(OH)2.
Hướng dẫn giải
Al(OH)3, Zn(OH)2 là hiđroxit lưỡng tính nên vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Đối với Al(OH)3:
Phân li kiểu bazơ:
Phân li kiểu axit:
Đối với Zn(OH)2:
Phân li kiểu bazơ:
Phân li kiểu axit:
III. Bài tập tự luyện dạng 1
Câu 1: Theo thuyết A-rê-ni-ut, kết luận nào sau đây là đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là axit.
B. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
C. Một hợp chất có khả năng phân li ra cation trong nước là axit.
D. Một bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
Câu 2: Muối nào sau đây là muối axit?
A. NH4NO3. B. Na3PO4.
C. Ca(HCO3)2. D. CH3COOK.
Câu 3: Trong dung dịch H2CO3 (bỏ qua sự phân li của H2O) chứa số loại ion là
A. 2. B. 3.
C. 4. D. 5.
Câu 4: Đặc điểm phân li Zn(OH)2 trong nước là
A. theo kiểu bazơ.
B. vừa theo kiểu axit, vừa theo kiểu bazơ.
C. theo kiểu axit.
D. không phân li vì là bazơ yếu.
Câu 5: Chất nào dưới đây là hiđroxit lưỡng tính?
A. Fe(OH)3. B. Al.
C. Al(OH)3. D. CuSO4.
Dạng 2: Xác định nồng độ ion trong dung dịch chất điện li
Phương pháp giải
Bước 1: Tính số mol các chất.
Bước 2: Viết phương trình điện li của các chất.
Căn cứ vào dữ kiện và yêu cầu của đầu bài, biểu diễn số mol các chất trong phương trình theo từng thời điểm.
Bước 3: Tính tổng thể tích (nếu đề bài cho sẵn thì bỏ qua bước này).
Bước 4: Tính toán theo yêu cầu của đề bài.
Ví dụ: Trộn 100 ml dung dịch NaCl 0,10M với 100 ml dung dịch Na2SO4 0,10M. Xác định nồng độ các ion có mặt trong dung dịch.
Hướng dẫn giải
Phương trình điện li:
mol
mol
lít.
Theo phương trình:
Nồng độ của các ion trong dung dịch sau trộn:
Ví dụ mẫu
Ví dụ 1: Trộn 50 ml dung dịch NaCl 2M với 150 ml dung dịch BaCl2 xM, thu được dung dịch Y có nồng độ ion là 1,1M. Giá trị của x là
A. 0,2. B. 0,3.
C. 0,4 D. 0,5.
Hướng dẫn giải
lít
Nồng độ của ion trong dung dịch Y:
Chọn C.
IV. Bài tập tự luyện dạng 2
Câu 1: Tính nồng độ mol/lít của các ion có trong dung dịch sau:
a) Hòa tan 9,8 gam H2SO4 vào nước thu được 200 ml dung dịch.
b) Trộn lẫn 500 ml dung dịch NaNO3 1M và 200 ml dung dịch NaOH 30% .
c) Trộn 200 ml dung dịch CaCl2 0,5M và 300 ml KCl 2M.
d) Trộn 100 gam Fe2(SO4)3 4% với 120 ml dung dịch FeCl3 0,1M.
e) Cho 0,23 gam Na và H2O thu được 100 ml dung dịch Y.
Dạng 3: Phương pháp bảo toàn điện tích trong giải bài tập sự điện li
Phương pháp giải
Định luật bảo toàn điện tích: Trong dung dịch tổng điện tích dương bằng tổng điện tích âm. Nguyên tử, phân tử, dung dịch luôn luôn trung hòa về điện:
Quá trình áp dụng định luật bảo toàn điện tích thường kết hợp:
Các phương pháp bảo toàn khác: Bảo toàn khối lượng, bảo toàn nguyên tố.
Viết phương trình hóa học ở dạng ion thu gọn.
Ví dụ: Cho 500 ml dung dịch X có các ion và nồng độ tương ứng như sau: 0,6M; 0,3M; 0,1; aM.
a) Tính a.
b) Tính khối lượng chất rắn khan thu được khi cô cạn dung dịch X.
c) Nếu dung dịch X được tạo nên từ hai muối thì hai muối đó là muối nào? Tính khối lượng mỗi muối cần hòa tan vào nước để thu được 1 lít dung dịch có nồng độ mol của các ion như trong dung dịch X.
Hướng dẫn giải
a) Ta có:
Bảo toàn điện tích:
b)
Ta có:
c) Dung dịch được tạo từ hai muối là Na2SO4 (0,15 mol) và KNO3 (0,05 mol).
Khối lượng mỗi muối cần dùng là:
Ví dụ mẫu
Ví dụ 1: Dung dịch X có chứa 0,10 mol ; 0,15 mol ; 0,20 mol và x mol . Giá trị của x là
A. 0,10. B. 0,05.
C. 0,15. D. 0,20.
Hướng dẫn giải
Bảo toàn điện tích:
Chọn A.
Ví dụ 2: Cô cạn dung dịch có chứa 0,2 mol ; 0,1 mol và ion thì thu được muối khan có khối lượng là
A. 55,3 gam. B. 59,5 gam
C. 50,9 gam. D. 26,1 gam.
Hướng dẫn giải
Bảo toàn điện tích:
Ta có:
Chọn C
V. Bài tập tự luyện dạng 3
Bài tập cơ bản
Câu 1: Dung dịch X có chứa a mol ; b mol ; c mol và d mol . Biểu thức liên hệ giữa a, b, c, d là
A. B. C. D.
Câu 2: Dung dịch X có chứa 0,15 mol ; mol ; 0,10 mol và x mol . Giá trị của x là
A. 0,25. B. 0,05. C. 0,15. D. 0,20.
Câu 3: Dung dịch A chứa 0,02 mol ; 0,03 mol ; x mol và y mol . Tổng khối lượng muối tan trong A là 5,435 gam. Giá trị của x và y lần lượt là
A. 0,01 và 0,03. B. 0,05 và 0,01. C. 0,03 và 0,02. D. 0,02 và 0,05.
Bài tập nâng cao
Câu 4: Dung dịch X chứa 0,12 mol , x mol ; 0,12 mol và 0,05 mol . Cho 300 ml dung dịch Ba(OH)2 0,1M vào X đến khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa, thu được dung dịch Y. Cô cạn Y, thu được m gam chất rắn khan. Giá trị của m là
A. 7,190. B. 7,020. C. 7,875. D. 7,705.
Câu 5: Dung dịch X chứa các ion: . Chia dung dịch thành hai phần bằng nhau. Phần (1) tác dụng với NaOH dư, đun nóng, được 0,672 lít khí (đktc) và 1,07 gam kết tủa. Phần (2) tác dụng với lượng dư dung dịch BaCl2, thu được 4,66 gam kết tủa. Khối lượng muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bị bay hơi).
A. 3,73 gam. B. 7,04 gam. C. 7,46 gam. D. 3,52 gam.
Đáp án và lời giải
Dạng 1: Câu hỏi lí thuyết về axit, bazơ, muối và viết phương trình điện li của các chất (nếu có)
|
1 – C |
2 – C |
3 – B |
4 – B |
5 – C |
Dạng 2: Xác định nồng độ ion trong dung dịch chất điện li.
Câu 1:
a.
b.
c.
d.
e.
Dạng 3. Phương pháp bảo toàn điện tích trong giải bài tập sự điện li
|
1 – A |
2 – A |
3 – C |
4 – C |
5 – C |