Tailieumoi.vn sưu tầm và biên soạn chuyên đề Phản ứng trao đổi ion trong dung dịch các chất điện li gồm đầy đủ lý thuyết, các dạng bài tập chọn lọc và ví dụ minh họa từ cơ bản đến nâng cao giúp học sinh ôn luyện kiến thức, biết cách làm bài tập môn Hóa học 11.
Chuyên đề Phản ứng trao đổi ion trong dung dịch các chất điện li
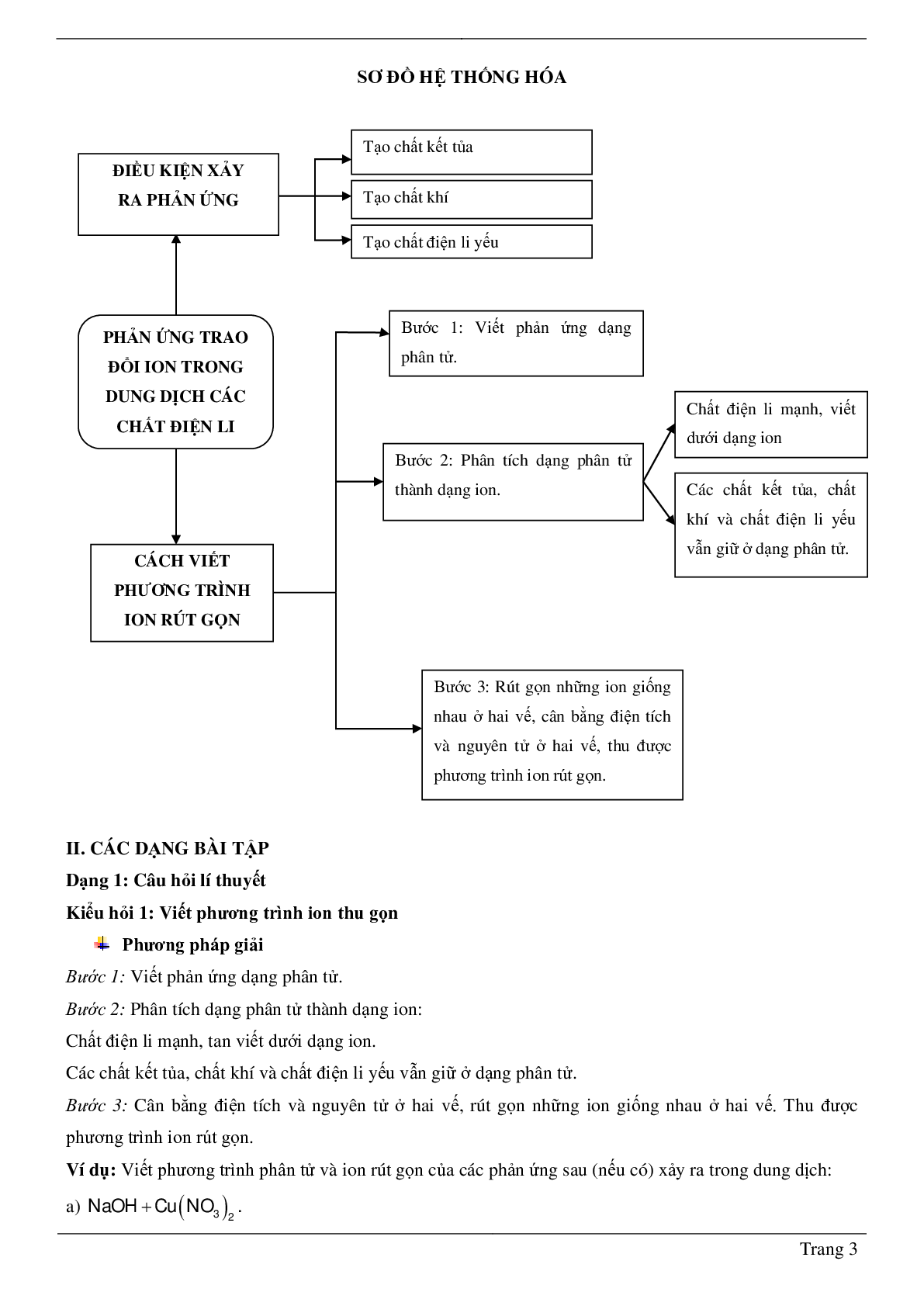
I. LÍ THUYẾT TRỌNG TÂM
1. Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li
a. Phản ứng tạo thành chất kết tủa
Thí nghiệm: Cho dung dịch Na2SO4 phản ứng với dung dịch BaCl2
Phương trình dạng phân tử:
Trắng
Phương trình ion đầy đủ:
Phương trình ion rút gọn:
Phương trình ion rút gọn thực chất là phản ứng giữa ion và tạo kết tủa .
Chú ý: Chất điện li mạnh thì viết dưới dạng ion. Chất khí, chất kết tủa, chất điện li yếu viết dưới dạng phân tử.
b. Phản ứng tạo thành chất điện li yếu
Phản ứng tạo thành nước
Thí nghiệm: Cho dung dịch HCl phản ứng với dung dịch NaOH.
Phương trình phân tử:
Phương trình ion đầy đủ:
Phương trình ion rút gọn:
Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì tạo thành chất điện li rất yếu là H2O.
Bản chất của phản ứng do ion và ion kết hợp với nhau tạo H2O.
Phản ứng tạo thành axit yếu
Thí nghiệm: Cho dung dịch CH3COONa phản ứng với dung dịch HCl.
Phương trình phân tử:
Phương trình ion đầy đủ:
Phương trình ion thu gọn:
Chú ý: Trong dung dịch ion sẽ kết hợp với ion tạo thành chất điện li yếu là CH3COOH.
c. Phản ứng tạo thành chất khí
Thí nghiệm: Cho dung dịch HCl phản ứng với dung dịch Na2CO3
Phương trình phân tử:
Phương trình ion đầy đủ:
Phương trình ion thu gọn:
Phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra vì vừa tạo chất điện li yếu là H2O vừa tạo chất khi CO2.
Các muối cacbonat ít tan trong nước nhưng tan dễ dàng trong các dung dịch axit.
Ví dụ:
2. Kết luận
Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
Chất kết tủa.
Chất điện li yếu như H2O, CH3COOH, HF…
Chất khí.
II. CÁC DẠNG BÀI TẬP
Dạng 1: Câu hỏi lí thuyết
Kiểu hỏi 1: Viết phương trình ion thu gọn
Phương pháp giải
Bước 1: Viết phản ứng dạng phân tử.
Bước 2: Phân tích dạng phân tử thành dạng ion:
Chất điện li mạnh, tan viết dưới dạng ion.
Các chất kết tủa, chất khí và chất điện li yếu vẫn giữ ở dạng phân tử.
Bước 3: Cân bằng điện tích và nguyên tử ở hai vế, rút gọn những ion giống nhau ở hai vế. Thu được phương trình ion rút gọn.
Ví dụ: Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có) xảy ra trong dung dịch:
a)
b)
c)
d)
Hướng dẫn giải
Phương trình phân tử
a)
b)
c)
d)
Phương trình ion đầy đủ:
a)
b)
c)
d)
Phương trình ion rút gọn:
a)
b)
c)
d)
Ví dụ mẫu
Ví dụ 1: Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có) xảy ra trong dung dịch:
a) b)
c)
Hướng dẫn giải
Phương trình phân tử
a)
b)
c)
Phương trình ion đầy đủ:
a)
b)
c)
Phương trình ion rút gọn:
a)
b)
c)
Kiểu hỏi 2: Từ phương trình ion rút gọn tìm phương trình hóa học dạng phân tử tương ứng
Phương pháp giải
Bước 1: Từ phương trình ion rút gọn nhận dạng xem đây là loại phương trình ion rút gọn thuộc dạng nào (sản phẩm có kết tủa, chất điện li yếu, khí).
Bước 2: Nhìn sản phẩm có chất kết tủa, chất điện li yếu, chất khí để tìm phương trình hóa học dạng phân tử.
Ví dụ: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là ?
A.
B.
C.
D.
Hướng dẫn giải
là phương trình ion thuộc phản ứng tạo thành chất điện li yếu (nước).
Phương trình hóa học thỏa mãn:
Chọn A.
Ví dụ mẫu
Ví dụ 1: Phương trình là phương trình ion rút gọn của phản ứng
A.
B.
C.
D.
Hướng dẫn giải
Phương trình ion rút gọn của các phản ứng:
A.
B.
C.
D.
Chọn B.
Kiểu hỏi 3: Chất, ion không thể hoặc có thể chứa đồng thời hoặc không đồng thời trong cùng một dung dịch
Phương pháp giải
Chất hoặc ion có thể tồn tại trong cùng một dung dịch khi các chất hoặc ion đó kết hợp với nhau không tạo ra kết tủa hoặc bay hơi hoặc chất điện li yếu.
Chất hoặc ion không thể tồn tại trong cùng một dung dịch khi các chất hoặc ion đó kết hợp với nhau tạo ra kết tủa hoặc bay hơi hoặc chất điện li yếu.
Bước 1: Nhìn chất, hoặc ion nào kết hợp với nhau tạo ra kết tủa hoặc chất khí hoặc chất điện li yếu.
Bước 2: Từ bước 1 dùng phương pháp loại trừ tìm ra đáp án.
Ví dụ: Không thể có dung dịch chứa đồng thời các ion
A. .
B.
C.
D. A và C đúng.
Hướng dẫn giải
Các ion trong dãy A không thể tồn tại trong cùng một dung dịch vì
Các ion trong dãy B: không kết hợp với nhau tạo ra chất kết tủa, chất khí hoặc chất điện li yếu nên các ion trong B có thể tồn tại trong cùng một dung dịch.
Các ion trong dãy C không thể tồn tại trong cùng một dung dịch vì
Chọn D.
Ví dụ mẫu
Ví dụ 1: Dãy gồm các ion cùng tồn tại trong một dung dịch là:
A.
B.
C.
D.
Hướng dẫn giải
Các ion trong dãy A, B, D không thể tồn tại trong cùng một dung dịch vì
Các ion trong dãy C không kết hợp với nhau tạo chất kết tủa, chất khí hay chất điện li yếu nên tồn tại trong cùng một dung dịch.
Chọn C.
III. Bài tập tự luyện dạng 1
Bài tập cơ bản
Câu 1: Phương trình ion rút gọn của phản ứng cho biết
A. những ion nào tồn tại trong dung dịch.
B. nồng độ những ion nào trong dung dịch lớn nhất.
C. bản chất của phản ứng trong dung dịch các chất điện li.
D. không tồn tại phân tử trong dung dịch các chất điện li.
Câu 2: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. các chất phản ứng phải là những chất dễ tan.
B. các chất phản ứng phải là những chất điện li mạnh.
C. một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
D. phản ứng không phải là thuận nghịch.
Câu 3: Các ion có thể tồn tại trong cùng một dung dịch (không kể sự phân li của nước) là:
A.
B.
C.
D.
Câu 4: Chất không tạo kết tủa khi cho vào dung dịch AgNO3 là
A. KBr. B. K3PO4.
C. HCl. D. HNO3.
Câu 5: Phản ứng có phương trình ion thu gọn là
A.
B.
C.
D. .
Câu 6: Cho Mg(OH)2 tác dụng với dung dịch HCl. Phương trình ion rút gọn của phản ứng là
A. .
B.
C.
D.
Câu 7: Dãy gồm các ion cùng tồn tại trong một dung dịch là
A.
B.
C.
D.
Bài tập nâng cao
Câu 8: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch (không kể sự phân li của nước) là:
A.
B.
C.
D.
Câu 9: Cho các phản ứng sau:
(a)
(b)
(c)
(d)
(e)
Số phản ứng có phương trình ion rút gọn là
A. 4. B. 3.
C. 2. D. 1.
Câu 10: Cho các phản ứng:
(1) (2) (3)
(4) (5) (6)
Dãy gồm các phản ứng có cùng phương trình ion rút gọn là:
A. (2), (3).
B. (2), (3), (4), (5), (6).
C. (1), (6).
D. (4), (5), (6).
Câu 11: Dùng phản ứng trao đổi ion để tách
a) Ion ra khỏi dung dịch chứa các chất tan Mg(NO3)2 và KNO3.
b) Ion ra khỏi dung dịch chứa các chất tan K3PO4 và KNO3.
Dạng 2: Bài tập bảo toàn điện tích và phản ứng trao đổi ion trong dung dịch
Ví dụ mẫu
Ví dụ 1: Dung dịch X chứa m gam ba ion: . Chia dung dịch X thành hai phần bằng nhau:
Phần một cho tác dụng với dung dịch KOH thu được 5,8 gam kết tủa.
Phần hai đun nóng với dung dịch NaOH dư thu được 3,36 lít khí (đktc).
Giá trị của m là
A. 77,4. B. 43,8.
C. 21,9. D. 38,7.
Hướng dẫn giải
Xét một phần:
Phương trình hóa học:
mol
Xét phần hai:
Phương trình hóa học:
mol
Trong mỗi phần có: 0,1 mol và 0,15 mol .
Bảo toàn điện tích trong mỗi phần:
Vậy
Chọn B.
|
Chú ý: Với các bài toán chia làm hai phần, ghi nhớ phải lấy khối lượng mỗi phần đem nhân với 2 để ra khối lượng ban đầu |
IV. Bài tập tự luyện dạng 2
Bài tập cơ bản
Câu 1: Cho hai dung dịch, mỗi dung dịch chứa hai cation và hai anion trong số các ion sau: (0,15 mol); (0,1 mol); (0,25 mol); (0,2 mol); (0,1 mol); (0,075 mol); (0,25 mol) và (0,15 mol). Một trong hai dung dịch chứa:
A.
B.
C.
D.
Câu 2: Cho dung dịch X chứa 0,1 mol ; 0,2 mol ; 0,2 mol ; x mol ; y mol Cu2+
Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa.
Nếu cho dung dịch NaOH dư vào dung dịch X thì khối lượng kết tủa thu được là
A. 27,20 gam. B. 25,30 gam.
C. 26,40 gam. D. 21,05 gam.
Câu 3: Trong y học, dược phẩm Nabica (NaHCO3) là chất dùng để trung hòa bớt lượng axit HCl trong dạ dày.
a) Viết phương trình hóa học dưới dạng phân tử và dạng ion rút gọn của phản ứng.
b) Nồng độ axit trong dạ dày 0,035M, tính thể tích dung dịch HCl được trung hòa và thể tích CO2 (đktc) sinh ra khi uống 0,336 gam NaHCO3
Câu 4: Cho 100 ml dung dịch H2SO4 0,5M tác dụng với 150 ml dung dịch Ba(OH)2 0,5M.
a) Tính CM của các ion trong dung dịch sau phản ứng.
b) Tính pH của dung dịch thu được.
Bài tập nâng cao
Câu 5: Cho rất từ từ 0,2 lít dung dịch HCl 1M vào 0,2 lít dung dịch hỗn hợp KOH 0,5M; K2CO3 0,4M đến phản ứng hoàn toàn, thu được x lít khí ở đktc. Giá trị của x là
A. 1,120. B. 0,336.
C. 0,448. D. 2,240.
Câu 6: Dung dịch E chứa các ion: trong đó số mol của gấp đôi số mol của ion . Cho một nửa dung dịch E phản ứng với dung dịch NaOH dư thu được 4 gam kết tủa. Cho một nửa dung dịch E còn lại phản ứng với dung dịch Ca(OH)2 dư thu được 5 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch E thu được m gam chất rắn khan. Giá trị của m là
A. 11,84. B. 8,79.
C. 7,52. D. 7,09.
Câu 7: Một dung dịch X gồm 0,01 mol ; 0,02 mol ; 0,02 mol và a mol ion Y (bỏ qua sự điện li của nước). Ion Y và giá trị của a là
A. và 0,03. B. và 0,01.
C. OH- và 0,03. D. và 0,03.
THAM KHẢO ĐỀ KIỂM TRA 45 PHÚT SỐ 1 TRANG 264
Đáp án và lời giải
Dạng 1: Câu hỏi lí thuyết
|
1 – C |
2 – C |
3 – B |
4 – D |
5 – C |
6 – D |
7 – A |
8 – B |
9 – D |
10 – C |
Câu 11:
a)
b)
Dạng 2: Bài tập bảo toàn điện tích và phản ứng trao đổi ion trong dung dịch
Câu 1: Chọn B.
Câu 2: Chọn A.
Xét
Ta có:
Bảo toàn điện tích dung dịch X:
Xét
Sơ đồ phản ứng:
Câu 3:
a) Phương trình phân tử: (1)
Phương trình ion rút gọn:
b)
Theo phương trình (1):
lít
lít
Câu 4:
a)
Phương trình hóa học:
mol
mol
Thể tích dung dịch sau phản ứng bằng: lít
b) Ta có:
Câu 5: Chọn C.
Phương trình hóa học:
mol
mol
mol
Theo phương trình: lít
Câu 6: Chọn A.
Gọi số mol các ion có trong 1/2 dung dịch E lần lượt là a, b, c, 2b mol.
Xét phản ứng 1/2 dung dịch E tác dụng NaOH dư:
Phương trình hóa học:
mol
(1)
mol
Xét phản ứng 1/2 dung dịch E tác dụng Ca(OH)2 dư:
Phương trình hóa học:
mol
(2)
mol
Nhận thấy: số mol kết tủa ở phản ứng (2) nhiều hơn phản ứng (1) nên ở (1) hết.
và
Bảo toàn điện tích 1/2 dung dịch E:
Xét phản ứng cô cạn 1/2 dung dịch E:
Phương trình hóa học:
mol
Khối lượng chất rắn khi cô cạn toàn bộ dung dịch E là:
Câu 7: Chọn D.
Để ion tồn tại được trong dung dịch X thì không phản ứng với 3 ion còn lại Loại A và C.
Dựa vào đáp án, ta có a = 1.
Bảo toàn điện tích dung dịch X: