Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh bộ câu hỏi trắc nghiệm Hóa học lớp 9 Bài 18: Nhôm và các hợp chất của nhôm tác dụng với dung dịch kiềm chọn lọc, có đáp án. Tài liệu có 9 trang gồm 12 câu hỏi trắc nghiệm cực hay bám sát chương trình sgk Hóa học 9. Hi vọng với bộ câu hỏi trắc nghiệm Nhôm và các hợp chất của nhôm tác dụng với dung dịch kiềm có đáp án này sẽ giúp bạn ôn luyện trắc nghiệm để đạt kết quả cao trong bài thi trắc nghiệm môn Hóa học 9.
Giới thiệu về tài liệu:
- Số trang: 9 trang
- Số câu hỏi trắc nghiệm: 12 câu
- Lời giải & đáp án: có
Mời quí bạn đọc tải xuống để xem đầy đủ tài liệu Trắc nghiệm Nhôm và các hợp chất của nhôm tác dụng với dung dịch kiềm có đáp án – Hóa học lớp 9:

Nhôm và các hợp chất của nhôm tác dụng với dung dịch kiềm
Bài 1: Cho 5,4 gam bột nhôm vào 200 ml dung dịch NaOH, sau phản ứng thấy khối lượng dung dịch tăng 3,6 gam. Nồng độ mol/lít của dung dịch NaOH là
A. 0,45M
B. 1,00M
C. 0,75M
D. 0,50M
Lời giải
nAl = 0,2 mol
Gọi số mol Al phản ứng là x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
x → x → 1,5x
Khối lượng dung dịch tăng 3,6 gam => ∆mtăng = mAl – mH2 = 3,6 gam
=> 27x – 1,5x.2 = 3,6 => x = 0,15 mol
Theo PT: nNaOH = nAlphản ứng = 0,15 mol
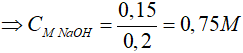
Đáp án: C
Bài 2: Để hòa tan hoàn toàn m gam Al cần dùng 100 ml dung dịch chứa NaOH 1M và Ba(OH)2 0,5M. Giá trị của m là
A. 5,4 gam
B. 3,6 gam
C. 7,2 gam
D. 4,5 gam
Lời giải
nNaOH = 0,1 mol; nBa(OH)2 = 0,05 mol
PTHH:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 ← 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,1 ← 0,05 mol
=> ∑nAlphản ứng = 0,1 + 0,1 = 0,2 mol => mAl = 0,2.27 = 5,4 gam
Đáp án: A
Bài 3: Hòa tan a gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 17,92 lít H2 (đktc). Cũng hỗn hợp trên hòa tan hoàn toàn trong dung dịch NaOH dư thu được 13,44 lít H2 (đktc). Giá trị của a là
A. 3,9
B. 7,8
C. 11,7
D. 15,6
Lời giải
Hòa tan trong NaOH => chỉ có Al phản ứng
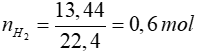
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,4 mol ← 0,6 mol
Hòa tan trong HCl cả 2 kim loại đều tạo khí
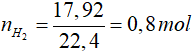
2Al + 6HCl → 2AlCl3 + 3H2
0,4 mol → 0,6 mol
Mg + 2HCl → MgCl2 + H2
0,2 mol ← 0,2 mol
=> a = mAl + mMg = 0,4.27 + 24.0,2 = 15,6 gam
Đáp án: D
Bài 4: Cho hỗn hợp gồm Na và Al có tỉ lệ số mol tương ứng là 1 : 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (ở đktc) và m gam chất rắn không tan. Giá trị của m là
A. 5,4
B. 10,8
C. 7,8
D. 43,2
Lời giải
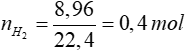
Gọi số mol Na là a mol => số mol của Al là 2a mol
m gam chất rắn không tan là Al => Al dư sau phản ứng với NaOH
2Na + 2H2O → 2NaOH + H2↑
a → a → 0,5a
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
a ← a → 1,5a
⇒∑nH2 = 0,5a + 1,5a = 0,4 ⇒ a = 0,2
=> nAl dư = 2a – a = a = 0,2 => m = 5,4 gam
Đáp án: A
Bài 5: Hòa tan hỗn hợp A gồm 13,7g Ba và 5,4g Al vào một lượng nước dư thì thể tích khí thoát ra ở đktc là:
A. 6,72 lít
B. 4,48 lít
C. 13,44 lít
D. Một kết quả khác
Lời giải
nBa =0,1 mol
nAl = 0,2 mol
Ta có
Ba + 2H2O → Ba(OH)2 + H2
0,1 mol →0,1 mol 0,1 mol
Ba(OH)2 + 2Al +2H2O → Ba(AlO2)2 + 3H2
Ban đầu 0,1 mol 0,2 mol
Sau pư 0 0 0,3 mol
→nH2= 0,4 mol → V =8,96 lít
Đáp án: D
Bài 6: Hỗn hợp X gồm K và Al. Cho 12 gam hỗn hợp X vào một lượng dư nước thì thoát ra 4,48 lít khí H2 (đktc) và còn lại một phần chất rắn chưa tan. Nếu cho m gam hỗn hợp X vào dung dịch KOH dư thì thu được bao nhiêu lít khí H2 (đktc)?
A. 6,72 lít
B. 11,2 lít
C. 4,48 lít
D. 8,96 lít
Lời giải
Phần chất rắn chưa tan là Al còn dư
Gọi nK = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
2K + 2H2O → 2KOH + H2
x → x → 0,5x
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
x ← x → 1,5x
⇒∑nH2 = 0,5x + 1,5x = 0,2 ⇒ x= 0,1 mol
Ta có: mhhX = mK + mAlphản ứng + mAldư
=> mAldư = 12 – 0,1.39 – 0,1.27 = 5,4 gam
=> nAltronghh X = 0,1 + 0,2 = 0,3 mol
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H2O và Al phản ứng hết với KOH
2K + 2H2O → 2KOH + H2
0,1 mol → 0,05 mol
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
0,3 mol → 0,45 mol
⇒∑nH2 = 0,05 + 0,45 = 0,5 ⇒ V = 11,2
Đáp án: B
Bài 7: Hòa tan 2,7 gam Al vào dung dịch NaOH dư thu được V lít khí thoát ra ở đktc. Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 5,60
Lời giải
nAl = 0,1 mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,1 mol → 0,15 mol
⇒ VH2 = 0,15.22,4 = 3,36 lít
Đáp án: B
Bài 8: Hoà tan hỗn hợp A gồm 13,7 gam Ba và 5,4 gam Al vào một lượng nước có dư thì thể tích khí thoát ra ở điều kiện tiêu chuẩn là
A. 6,72 lít
B. 8,96 lít
C. 13,44 lít
D. 4,48 lít
Lời giải
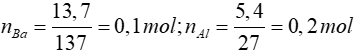
Ba + 2H2O → Ba(OH)2 + H2↑
0,1 mol → 0,1 mol → 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,2 ← 0,1 mol → 0,3 mol
⇒∑nH2 = 0,1 + 0,3 = 0,4 ⇒ VH2 = 0,4.22,4 = 8,96
Đáp án: B
Bài 9: Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
A. a : b = 1 : 4
B. a : b < 1 : 4
C. a : b = 1 : 5
D. a : b > 1 : 4
Lời giải
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
a → 3a → a
Al(OH)3 + NaOH → NaAlO2 + 2H2O
a → a
Nếu nNaOH = 4a thì kết tủa sẽ tan hết => để có kết tủa thì: nNaOH < 4a => b < 4a
=> a : b > 1 : 4
Đáp án: D
Bài 10: TN1: Nhỏ từ từ V1 lít dung dịch Ba(OH)2 xM (dung dịch X) vào V2 lít dung dịch ZnSO4 y M (dung dịch Y) thì phản ứng vừa đủ và thu được kết tủa lớn nhất.
TN2: Nếu nhỏ từ từ V2 lít dung dịch X vào V2 lít dung dịch Y (ở trên) thì phản ứng vừa đủ và thu được kết tủa nhỏ nhất.
Xác định giá trị x/y và V1/ V2?
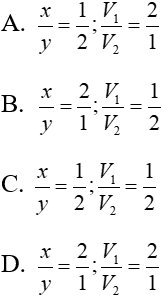
Lời giải
TN1: Ba(OH)2 + ZnSO4 BaSO4↓ + Zn(OH)2↓ (1)
V1x V2y
Ta có: V1x=V2y (*)(vì phản ứng vừa đủ)
Theo (1): nZn(OH)2 = nZnSO4 = V2y (mol)
TN2: xảy ra pư (1) và pư:
Ba(OH)2 + Zn(OH)2↓ → BaZnO2 +H2O (2)
V2y ← V2y
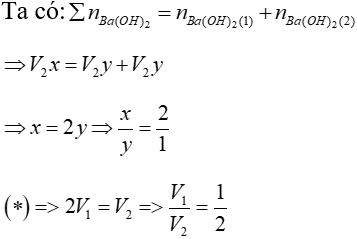
Đáp án: B
Bài 11: Cho 200 ml dung dịch NaOH 2M tác dụng hoàn toàn với 200 ml dung dịch AlCl3 aM. Sau phản ứng thu được 7,8 gam kết tủa nhôm hiđroxit. Giá trị của a là:
A. 0,5M B. 0,625M
C. 2M D. Cả A và B
Lời giải
3NaOH + AlCl3 → 3NaCl + Al(OH)3 (1)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
Theo đề bài ta có: nNaOH = 0,4 mol; nAlCl3 = 0,2a (mol); nAl(OH)3= 7,8 : 78 = 0,1 mol
Vì nNaOH > 3nAl(OH)3 nên sau phản ứng (1) dư NaOH => xảy ra cả phản ứng (2)
3NaOH + AlCl3 → 3NaCl + Al(OH)3 (1)
Bđ: 0,4 0,2a
Pư: 0,6a ← 0,2a → 0,2a
Sau: 0,4-0,6a 0 0,2a
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
Bđ: 0,4-0,6a 0,2a
Pư: 0,4-0,6a → 0,4-0,6a
Sau: 0 0,8a-0,4
Sau phản ứng ta thu được 0,1 mol kết tủa => 0,8a - 0,4 = 0,1 => a = 0,625
Đáp án: B
Bài 12: Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dung dịch NaOH dư thì được 1,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X là
A. 39,87%. B. 77,31%.
C. 29,87%. D. 49,87%.
Lời giải
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
2Na + 2H2O → 2NaOH + H2
x → x → 0,5x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x ← x → 1,5x
⇒∑nH2 = 0,5x + 1,5x = a ⇒ x = 0,5a
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH
2Na + 2H2O → 2NaOH + H2
x mol → 0,5x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
y mol → 1,5y mol
⇒∑nH2 = 0,5x + 1,5y = 1,75a
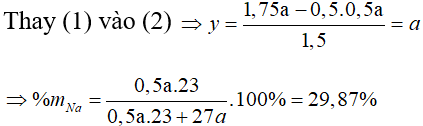
Đáp án: C