Tailieumoi.vn giới thiệu Giải bài tập Hóa Học lớp 11 Bài 1: Sự điện li chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Sự điện li lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 1: Sự điện li
Câu hỏi và bài tập (trang 7 sgk Hóa học lớp 11)
Bài 1 trang 7 sgk Hóa học 14: Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì ?
Lời giải
Các dung dịch HCl, NaOH, NaCl dẫn điện được vì khi hòa tan trong nước thì các chất này phân li ra các ion âm và ion dương chuyển động tự do trong dung dịch
Thí dụ:
HCl H+ + Cl-
NaOH Na+ + OH-
NaCl Na+ + Cl-
Các dung dịch ancol etylic, saccarozơ, glixerol không dẫn điện được vì khi hòa tan trong nước không phân li ra ion âm và ion dương.
Bài 2 trang 7 sgk Hóa học 14: Sự điện li, chất điện li là gì ?
Những loại chất nào là chất điện li ? Thế nào là chất điện li mạnh, chất điện li yếu ?
Lấy thí dụ và viết phương trình điện li của chúng.
Lời giải
- Quá trình phân li các chất trong nước ra ion gọi là sự điện li.
- Những chất tan trong nước phân li ra ion gọi là những chất điện li.
- Axit, bazơ, muối là những chất điện li.
- Chất điện li mạnh là các chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Ví dụ: NH4Cl -> NH4+ + Cl–
- Chất điện li yếu là chất khi tan trong nước, các phân tử hòa tan chỉ phân li một phần ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: CH3COOH ⇔ CH3COO– + H+
Bài 3 trang 7 sgk Hóa học 14: Viết phương trình điện li của những chất sau:
a) Các chất điện li mạnh: Ba(NO3)2 0,10M; HNO3 0,020M ; KOH 0,010M.
Tính nồng độ mol của từng ion trong các dung dịch trên.
b) Các chất điện li yếu: HClO, HNO2.
Lời giải
a) Các chất điện li mạnh phân li hoàn toàn nên phương trình điện li và nồng độ các ion trong dung dịch như sau:
Ba(NO3)2 → Ba2+ + 2NO-3
0,10M 0,10M 0,20M
HNO3 → H+ + NO-3
0,020M 0,020M 0,020M
KOH → K+ + OH-
0,010M 0,010M 0,010M
b) Các chất điện li yếu phân li không hoàn toàn nên phương trình điện li như sau:
HClO H+ + ClO-
HNO2 H+ + NO-2
Bài 4 trang 7 sgk Hóa học 14: Chọn câu trả lời đúng trong các câu sau đây:
Dung dịch chất điện li dẫn điện được là do
A. sự chuyển dịch của các electron.
B. sự chuyển dịch của các cation.
C. sự chuyển dịch của các phân tử hòa tan.
D. sự chuyển dịch của cả cation và anion.
Lời giải
Dung dịch chất điện li dẫn điện được do sự chuyển dịch của cả cation và anion.
Đáp án D.
Bài 5 trang 7 sgk Hóa học 14: Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước.
Lời giải
KCl rắn tồn tại dưới dạng tinh thể ion. Mạng tinh thể KCl tương tự mạng tinh thể NaCl (hình 3.1 SGK lớp 10). Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các ion K+ và Cl- chỉ dao động tại các đầu nút của mạng tinh thể (không chuyển dịch tự do) vì vậy, KCl rắn, khan không dẫn điện.
Đáp án A
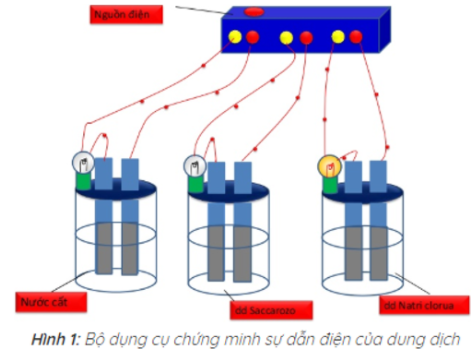
=> Kết quả thí nghiệm cho thấy chỉ có bóng đèn ở cốc đựng dung dịch NaCl sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozo không dẫn điện.
- Sự điện li là quá trình phân li các chất trong nước hoặc khi nóng chảy thành ion.
- Dung dịch (dd) dẫn điện được là do trong dung dịch của chúng có các hạt mang điện tích chuyển động tự do được gọi là các ion.
- Chất điện li là những chất khi tan trong nước phân li ra ion.
- Axit, bazơ, muối đều là những chất điện li.
II. PHÂN LOẠI
1.Chất điện li mạnh
- Là chất khi tan trong nước, các phân tử hòa tan phân li hoàn toàn.
VD:
Na2SO4 → 2Na+ + SO42-
KOH → K+ + OH-
HNO3 → H+ + NO3–
- Các axit mạnh, bazơ mạnh và hầu hết các muối là chất điện li mạnh.
2. Chất điện li yếu
- Là chất khi tan trong nước, số phân tử hòa tan phân li một phần, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Các axit yếu, bazơ yếu và một số muối là chất điện li yếu.
VD: CH3COOH ↔ CH3COO- + H+
3. Chất không điện li
- Là những chất khi tan trong nước không phân li ra ion.
VD: Dung dịch đường, dung dịch rượu, ...
III. CÂN BẰNG ĐIỆN LI
- Sự phân li của các chất điện li yếu là quá trình thuận nghịch. Khi tốc độ phân li của phân tử chất điện li (phản ứng thuận) bằng tốc độ kết hợp giữa các ion thành phân tử chất điện li (phản ứng nghịch) thì cân bằng của quá trình điện li được thiết lập.
Độ điện li: (α) : α = =
Với : n là số phân tử phân li ra ion, nolà số phân tử hòa tan.
C là nồng độ mol chất tan phân li thành ion, Co là nồng độ mol chất hòa tan.
Sơ đồ tư duy: Sự điện li.
Phương pháp giải một số dạng bài tập về sự điện li
Dạng 1: Lý thuyết về sự điện li
* Một số lưu ý cần nhớ:
- Sự điện li là quá trình phân li các chất trong nước ra ion.
- Những chất tan trong nước phân li ra ion được gọi là những chất điện li.
=> Axit, bazo, muối đều là những chất điện li
Chất điện li được phân thành chất điện li mạnh và chất điện li yếu.
+ Chất điên li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
+ Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng
* Một số ví dụ điển hình:
Ví dụ 1: Dãy nào sau đây chỉ chứa các chất điện li mạnh:
A. NaNO3, HClO3, NaHSO4, Na2S, NH4Cl.
B. NaNO3, Ba(HCO3)2, HF, AgCl, NH4Cl.
C. NaNO3, HClO3, H2S, Mg3(PO4)2, NH4Cl.
D. NaNO3, HClO3, Na2S, NH4Cl, NH3.
Hướng dẫn giải chi tiết:
B sai do HF là chất điện li yếu
C loại do H2S là chất điện li yếu
D loại do NH3 là chất điện li yếu
Đáp án A
Ví dụ 2: Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước.
Hướng dẫn giải chi tiết:
KCl rắn, khan không điện li ra ion nên không có khả năng dẫn điện.
Đáp án A
Ví dụ 3: Câu nào sau đây đúng khi nói về sự điện li ?
A. Sự điện li là sự hòa tan một chất vào nước thành dung dịch.
B. Sự điện li là sự phân li một chất dưới tác dụng của dòng điện.
C. Sự điện li là sự phân li một chất thành ion dương và ion âm khi chất đó tan trong nước hay ở trạng thái nóng chảy.
D. Sự điện li thực chất là quá trình oxi hóa khử.
Hướng dẫn giải chi tiết:
Theo định nghĩa về sự điện li thì:
Sự điện li là sự phân li một chất thành ion dương và ion âm khi chất đó tan trong nước hay ở trạng thái nóng chảy.
Đáp án C.
Ví dụ 4: Cho các chất : H2O, HCl, NaOH, NaCl, CuSO4, HCOOH. Các chất điện li yếu là :
A. H2O, HCOOH, CuSO4
B. HCOOH, CuSO4.
C. H2O, HCOOH.
D. H2O, NaCl, HCOOH, CuSO4.
Hướng dẫn giải chi tiết:
Trong dãy trên có chứa các chất điện li yếu là: H2O, HCOOH.
Đáp án C.
Ví dụ 5: Các dung dịch sau đây có cùng nồng độ 0,10 mol/l, dung dịch nào dẫn điện kém nhất ?
A. HCl. B. HF.
C. HI. D. HBr.
Hướng dẫn giải chi tiết:
HF là chất điện li yếu => khi điện li sẽ điện li ra ít ion nhất => Dẫn điện kém nhất
Đáp án B.
Dạng 2: Xác định nồng độ các ion trong dung dịch chất điện li
* Một số lưu ý cần nhớ
Để làm được dạng bài tập này:
- Tính số mol chất điện li đang xét
=> Số mol ion có trong dung dịch chất điện li => Nồng độ ion có trong dung dịch chất điện li.
* Lưu ý: Khi trộn 2 thể tích dung dịch, các em cần tính tổng thể tích dung dịch lúc sau
* Một số ví dụ điển hình:
Ví dụ 1: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M. B. 0,8M.
C. 0,6M. D. 0,4M.
Hướng dẫn giải chi tiết:
Ta có phương trình điện li:
MgSO4 → Mg2+ + SO42-
0,1 0,1 (mol)
Al2(SO4)3 → 2Al3+ + 3SO42-
0,1 0,3 (mol)
nSO42- = 0,4 mol ⇒ CM(SO42-) = n : V = 0,4/(0,2 + 0,3) = 0,8M
Đáp án B
Ví dụ 2: Nồng độ mol/l của ion H+ trong dung dịch H2SO4 là 60% (D = 1,503 g/ml) là:
A. 12,4 M B. 14,4 M
C. 16,4 M D. 18,4 M
Hướng dẫn giải chi tiết:
Xét 100 gam dung dịch H2SO4 là 60%
mH2SO4 = m dd . C% = 100 . 0,6 = 60 gam
=> n H2SO4 = 60 : 98 = 0,6 (mol)
V = m dd : D = 100/1,503 = 66,5 ml
⇒ CM H2SO4 = 0,61/0,0665 = 9,2 M
Ta có: H2SO4 → 2H+ + SO42-
⇒ [H+] = 2 . CM H2SO4 = 18,4 M
Dạng 3: Bài toán liên quan đến độ điện li α.
* Một số lưu ý cần nhớ
Để làm được dạng bài tập này ta cần:
- Viết phương trình điện li
- Xác định nồng độ chất tại các thời điểm: ban đầu, cân bằng, sau phản ứng.
- Kết hợp cả công thức tính độ điện li để giải quyết được yêu cầu bài toán
Độ điện li: (α) : α = =
Với : n là số phân tử phân li ra ion, nolà số phân tử hòa tan.
C là nồng độ mol chất tan phân li thành ion, Co là nồng độ mol chất hòa tan.
* Một số ví dụ điển hình:
Ví dụ 1: Tính nồng độ mol của các ion CH3COOH, CH3COO-, H+ tại cân bằng trong dung dịch CH3COOH 0,1M có α= 1,32%.
Hướng dẫn giải chi tiết:
CH3COOH ↔ H+ + CH3COO- (1)
Ban đầu: Co 0 0
Phản ứng: Co. α Co . α Co . α
Cân bằng: Co.(1- α) Co . α Co . α
Vậy: [H+]= [CH3COO-] = a. Co = 0,1. 1,32.10-2M = 1,32.10-3M
[CH3COOH] = 0,1M – 0,00132M = 0,09868M
Ví dụ 2: Tính độ điện li của axit HCOOH 0,007M trong dung dịch có [H+]=0,001M
Hướng dẫn giải chi tiết
HCOOH + H2O ↔ HCOO- + H3O+
Ban đầu: 0,007 0
Phản ứng: 0,007. α 0,007. α
Cân bằng: 0,007(1- α) 0,007. α
Theo phương trình ta có: [H+] = 0,007. α = 0,001
=> α = 14%