Với giải Luyện tập 6 trang 37 Khoa học tự nhiên lớp 7 Cánh diều chi tiết trong Bài 5: Giới thiệu về liên kết hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học
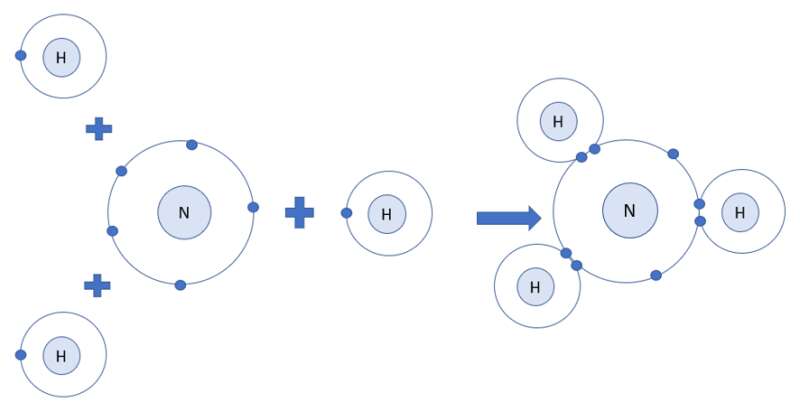
Luyện tập 6 trang 37 KHTN lớp 7: Mỗi nguyên tử N kết hợp với 3 nguyên tử H tạo thành phân tử ammonia. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử ammonia.
Phương pháp giải:
Nguyên tử H và nguyên tử N đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử N có 5 electron ở lớp ngoài cùng
Trả lời:
Nguyên tử H và nguyên tử N đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung
=> Sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và N:
Lý thuyết Liên kết cộng hóa trị
1. Sự tạo thành liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử.
- Chất được tạo thành nhờ liên kết cộng hóa trị giữa các nguyên tử được gọi là chất cộng hóa trị.
- Để có lớp vỏ electron bền vững tương tự khí hiếm, các nguyên tử phi kim sẽ góp các electron để tạo ra một hoặc nhiều đôi electron dùng chung giữa các nguyên tử và liên kết với nhau thành phân tử.
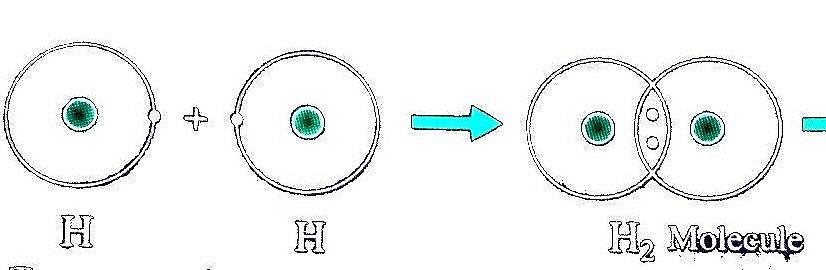
Ví dụ 1: Sự tạo thành liên kết trong phân tử hydrogen
+ Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thanh phân tử hydrogen. Liên kết như này được gọi là liên kết cộng hóa trị.
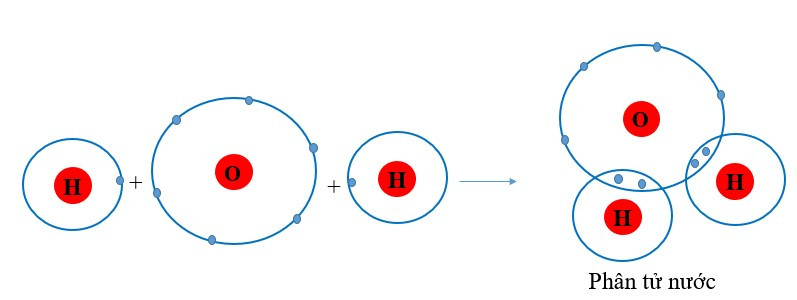
Ví dụ 2: Sự tạo thành liên kết trong phân tử nước
+ Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron. Giữa nguyên tử O và nguyên tử H có 1 electron dùng chung.
+ Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước.
2. Một số đặc điểm của chất cộng hóa trị
+ Có cả ba thể: thế rắn (đường ăn, iodine,…), thể lỏng (bromine, ethanol,…), thể khí (oxygen, nitrogen, khí carbonic,…).
+ Các chất cộng hóa trị thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp.
+ Nhiều chất cộng hóa trị không dẫn điện (đường ăn, ethanol,…).
Xem thêm các bài giải Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Luyện tập 4 trang 36 KHTN lớp 7: Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine...
Vận dụng trang 38 KHTN lớp 7: Hãy giải thích các hiện tượng sau:...
Câu hỏi 9 trang 38 KHTN lớp 7: So sánh một số tính chất chung của chất cộng hóa trị với chất ion...
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất
Bài 5: Giới thiệu về liên kết hóa học
Bài 6: Hóa trị, công thức hóa học