Với giải sách bài tập Khoa học tự nhiên 7 Bài 5: Giới thiệu về liên kết hóa học sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học
Bài 5.1 trang 15 SBT Khoa học tự nhiên 7: Nguyên tử khí hiếm là nguyên tử có
A. số electron trong nguyên tử là số chẵn.
B. số proton bằng số neutron.
C. tám electron ở lớp ngoài cùng (trừ He).
D. tám electron trong nguyên tử (trừ He).
Lời giải:
Đáp án đúng là: C
Nguyên tử khí hiếm là nguyên tử có tám electron ở lớp ngoài cùng (trừ He).
A. số lượng các nguyên tố khí hiếm rất nhỏ.
B. các nguyên tử khí hiếm có kích thước rất nhỏ.
C. các nguyên tử khí hiếm có lớp electron ngoài cùng bền vững.
D. các khí hiếm ở thể khí trong điều kiện thường.
Lời giải:
Đáp án đúng là: C
Các khí hiếm tồn tại dưới dạng nguyên tử độc lập, không tham gia liên kết với nguyên tử khác vì các nguyên tử khí hiếm có lớp electron ngoài cùng bền vững.
Bài 5.3 trang 15 SBT Khoa học tự nhiên 7: Khi hai nguyên tử A và B tạo ra liên kết ion với nhau thì
A. mỗi nguyên tử A và B đều nhận thêm electron.
B. một nguyên tử nhận thêm electron, một nguyên tử cho đi electron.
C. proton được chuyển từ nguyên tử này sang nguyên tử kia.
D. mỗi nguyên tử A và B đều cho đi electron.
Lời giải:
Đáp án đúng là: B
Khi hai nguyên tử A và B tạo ra liên kết ion với nhau thì một nguyên tử nhận thêm electron, một nguyên tử cho đi electron.
Nguyên tử cho electron chuyển thành ion dương, nguyên tử nhận electron chuyển thành ion âm.
Trong quá trình tạo ra liên kết hóa học, hạt nhân của các nguyên tử không thay đổi.
A. một số electron thích hợp ở ngoài cùng của mỗi nguyên tử.
B. tất cả các electron lớp ngoài cùng của hai nguyên tử.
C. tất cả các electron có trong hai nguyên tử.
D. một electron ở lớp ngoài cùng của mỗi nguyên tử.
Lời giải:
Đáp án đúng là: A
Các nguyên tử liên kết với nhau để tạo ra lớp electron ngoài cùng bền vững tương tự khí hiếm (với 8 electron).
Khi tạo thành liên kết cộng hóa trị, các electron góp chung được lấy từ lớp electron ngoài cùng của nguyên tử với số lượng thích hợp để tổng số electron lớp ngoài cùng (kể cả electron chung và riêng) của các nguyên tử là 8 electron (riêng H là 2 electron tương tự He).
A. proton trong các nguyên tử.
B. neutron trong các nguyên tử.
C. electron ở lớp trong cùng gần hạt nhân mỗi nguyên tử.
D. electron ở lớp ngoài cùng của mỗi nguyên tử.
Lời giải:
Đáp án đúng là: D
Khi các nguyên tử liên kết với nhau (liên kết ion, liên kết cộng hóa trị), chỉ có sự thay đổi số lượng electron ở lớp ngoài cùng của nguyên tử. Hạt nhân nguyên tử không thay đổi.
Bài 5.6 trang 16 SBT Khoa học tự nhiên 7: Hãy tìm từ thích hợp để điền vào chỗ …. trong các câu sau:
a) Liên kết giữa hai nguyên tử Cl là liên kết…..
b) Liên kết giữa hai nguyên tử H là liên kết …..
c) Nguyên tử Na liên kết với nguyên tử Cl bằng liên kết ….
d) Nguyên tử Cl liên kết với nguyên tử H bằng liên kết ….
e) Nguyên tử He ….. liên kết với các nguyên tử khác.
g) Mỗi nguyên tử H chỉ liên kết được với …. nguyên tử khác.
Lời giải:
a) Liên kết giữa hai nguyên tử Cl là liên kết cộng hóa trị.
b) Liên kết giữa hai nguyên tử H là liên kết cộng hóa trị.
c) Nguyên tử Na liên kết với nguyên tử Cl bằng liên kết ion.
d) Nguyên tử Cl liên kết với nguyên tử H bằng liên kết cộng hóa trị.
e) Nguyên tử He không liên kết với các nguyên tử khác.
g) Mỗi nguyên tử H chỉ liên kết được với một nguyên tử khác.
a) Các nguyên tử phi kim kết hợp với nhau để tạo ra hợp chất.
b) Giữa các nguyên tử có sự góp chung electron khi tạo ra hợp chất.
c) Các nguyên tử đã chuyển thành ion khi tạo ra hợp chất.
d) Có sự chuyển electron từ nguyên tử này sang nguyên tử khác khi tạo ra hợp chất.
Lời giải:
a) Liên kết cộng hóa trị được hình thành khi các nguyên tử phi kim kết hợp với nhau để tạo ra hợp chất.
b) Liên kết cộng hóa trị được hình thành giữa các nguyên tử có sự góp chung electron khi tạo ra hợp chất.
c) Liên kết ion được tạo thành khi các nguyên tử đã chuyển thành ion tạo ra hợp chất.
d) Liên kết ion được tạo thành khi có sự chuyển electron từ nguyên tử này sang nguyên tử khác khi tạo ra hợp chất.
a) K+ và F-
c) Mg2+ và O2-
d) Cl- và Br-
Lời giải:
Các cặp có thể tạo ra hợp chất ion là:
a) K+ và F-
c) Mg2+ và O2-
Cặp b) không thể tạo ra hợp chất ion do Ca2+ và Ba2+ mang điện tích cùng dấu.
Cặp d) không thể tạo ra hợp chất ion do Cl- và Br- mang điện tích cùng dấu.
Lời giải:
Nguyên tố O là phi kim nên có thể tạo ra liên kết ion với các kim loại Li, Mg; liên kết cộng hóa trị với các phi kim H, C và không có liên kết với khí hiếm He.
a) Hãy cho biết liên kết trong mỗi hợp chất được tạo thành là liên kết ion hay liên kết cộng hóa trị.
b) Xác định tỉ lệ giữa số nguyên tử H và nguyên tử C, N, O và Cl trong các hợp chất tạo thành.
c) Giải thích vì sao lại có sự khác nhau giữa các tỉ lệ ở trên.
Lời giải:
a) H là nguyên tố phi kim, liên kết của H với các phi kim C, N, O và Cl là liên kết cộng hóa trị.
b) Ta có bảng sau:
|
Cặp nguyên tố |
H và C |
H và N |
H và O |
H và Cl |
|
Tỉ lệ |
4 : 1 |
3 : 1 |
2 : 1 |
1 : 1 |
c) Có sự khác nhau giữa các tỉ lệ trên do số electron góp chung của các nguyên tố C, N, O và Cl là khác nhau.
a) Na và S.
b) H và Cl.
c) N và H.
d) Ca và O.
e) K và Cl.
Xác định tỉ lệ số nguyên tử của hai nguyên tố trong mỗi hợp chất tạo thành.
Lời giải:
- Chất tạo thành từ kim loại mạnh và phi kim mạnh là hợp chất ion, đó là:
|
Cặp nguyên tố |
Na và S |
Ca và O |
K và Cl |
|
Tỉ lệ |
2 : 1 |
1 : 1 |
1 : 1 |
- Chất tạo thành từ các phi kim là chất cộng hóa trị, đó là:
|
Cặp nguyên tố |
H và Cl |
N và H |
|
Tỉ lệ |
1 : 1 |
1 : 3 |
Bài 5.12 trang 17 SBT Khoa học tự nhiên 7:
a) Trong các nguyên tố Mg, Cl, O, Na và Ne, những cặp nguyên tố nào có thể tạo ra liên kết ion với nhau?
b) Trong các nguyên tố H, Na, Mg, O và He, những cặp nguyên tố nào có thể tạo ta liên kết cộng hóa trị với nhau?
Lời giải:
Chú ý:
- Liên kết ion được hình thành giữa kim loại mạnh và phi kim mạnh.
- Liên kết cộng hóa trị thường được hình thành giữa các nguyên tử phi kim với nhau.
a) Khí hiếm Ne không tham gia liên kết.
Liên kết ion được tạo thành giữa các cặp nguyên tố sau:
Mg và Cl; Mg và O; Na và Cl; Na và O.
b) Khí hiếm He không tham gia liên kết.
Liên kết cộng hóa trị được tạo ra giữa cặp nguyên tố O và H.
|
rắn, cao, lỏng, thấp, khí, dễ, không dẫn điện, ít, dẫn điện |
Ở điều kiện thường, các chất ion đều ở thể … (1) …, thường có nhiệt độ nóng chảy và nhiệt độ sôi … (2)… Các chất cộng hóa trị có ở thể … (3) …., ….(4)…. và …. (5)…., thường có nhiệt độ nóng chảy và nhiệt độ sôi …. (6) …. Các chất cộng hóa trị thường …. (7) …. tan trong nước và …. (8) …. còn các chất ion thường …. (9) …. tan trong nước tạo ra dung dịch …. (10)…
Lời giải:
Ở điều kiện thường, các chất ion đều ở thể (1) rắn, thường có nhiệt độ nóng chảy và nhiệt độ sôi (2) cao. Các chất cộng hóa trị có ở thể (3) rắn, (4) lỏng và (5) khí, thường có nhiệt độ nóng chảy và nhiệt độ sôi (6) thấp. Các chất cộng hóa trị thường (7) ít tan trong nước và (8) không dẫn điện còn các chất ion thường (9) dễ tan trong nước tạo ra dung dịch (10) dẫn điện.
a) Tính số electron có trong nguyên tử X.
b) Tính số proton có trong hạt nhân của nguyên tử Y.
Lời giải:
Nguyên tử X cho 1 electron để chuyển thành X+; nguyên tử Y nhận 1 electron để chuyển thành Y-. Vì X+ và Y- đều có 10 electron nên:
a) Nguyên tử X có: 10 electron + 1 electron = 11 electron.
b) Nguyên tử Y có: 10 electron – 1 electron = 9 electron.
Do đó số proton trong hạt nhân Y = số electron của Y = 9.
a) Nguyên tử X có tạo ra được liên kết với nguyên tử Y không?
b) Nếu X và Y liên kết được với nhau thì liên kết đó là liên kết ion hay liên kết cộng hóa trị? Viết sơ đồ minh họa sự tạo thành liên kết giữa X và Y.
Lời giải:
a) Nguyên tử X có 3 proton, do đó số electron của X là 3 và lớp ngoài cùng có 1 electron nên X là kim loại.
Nguyên tử Y có 9 electron, do đó lớp ngoài cùng của Y có 7 electron nên Y là phi kim.
Vậy nguyên tử X có tạo ra được liên kết với nguyên tử Y, do các nguyên tử này đều chưa đạt được lớp ngoài cùng bền vững giống với khí hiếm.
b) X là kim loại điển hình, Y là phi kim điển hình nên X liên kết với Y bằng liên kết ion.
Sơ đồ minh họa sự tạo thành liên kết ion giữa X với Y:
Nguyên tử X cho đi 1 electron ở lớp ngoài cùng trở thành ion mang một điện tích dương, kí hiệu là X+.
Nguyên tử Y có 7 electron ở lớp ngoài cùng, nhận 1 electron tử X để trở thành ion mang một điện tích âm, kí hiệu là Y-.
Các ion X+ và Y- mang điện tích trái dấu, hút nhau, tạo thành liên kết trong phân tử XY.
a) Mỗi nguyên tử R đã liên kết với bao nhiêu nguyên tử Y?
b) Số electron trong ion R2+ và ion Y- đều là 10 electron. Hãy cho biết R và Y là những nguyên tử của các nguyên tố hóa học nào.
Lời giải:
a) Nguyên tử R cho 2 electron để tạo thành ion R2+.
Nguyên tử Y nhận 1 electron để tạo thành ion Y-.
Vậy mỗi nguyên tử R kết hợp với hai nguyên tử Y.
b) R2+ có 10 electron nên R có 10 + 2 = 12 electron.
Vậy R có số proton = số electron = 12. R là Mg (magnesium).
Y- có 10 electron nên Y có 10 – 1 = 9 electron.
Vậy Y có số proton =số electron = 9. Y là F (fluorine).
Xem thêm các bài giải SBT Khoa học tự nhiên 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất
Bài 6: Hóa trị, công thức hóa học
Bài 8: Đồ thị quãng đường - thời gian
Lý thuyết KHTN 7 Bài 5: Giới thiệu về liên kết hóa học
I. Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
- Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.
- Một số mô hình cấu tạo vỏ nguyên tử của khí hiếm:
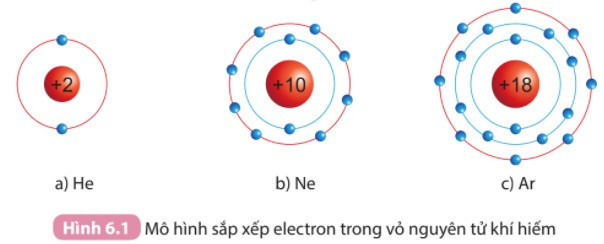
- Nguyên tử của nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo thành lớp vỏ tương tự khí hiếm khi liên kết với các nguyên tử khác.
II. Liên kết ion
1. Sự tạo thành liên kết ion
- Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm. Chất được tạo thành các ion dương và ion âm được gọi là hợp chất ion.
- Khi kim loại điển hình kết hợp với phi kim điển hình, nguyên tử kim loại sẽ cho electron tạo thành ion dương, nguyên tử phi kim sẽ nhận electron tạo thành ion âm. Các ion âm và ion dương hút nhau, tạo ra hợp chất ion.
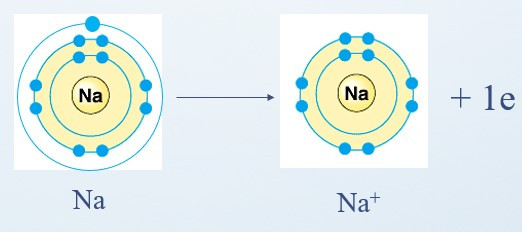
Ví dụ 1: Sự tạo thành liên kết trong phân tử sodium chloride:
+ Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+:
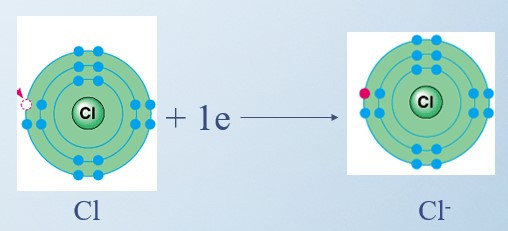
+ Nguyên tử Cl nhận 1 electron ở lớp ngoài cùng trở thành ion mang điện tích âm, kí hiệu là Cl-
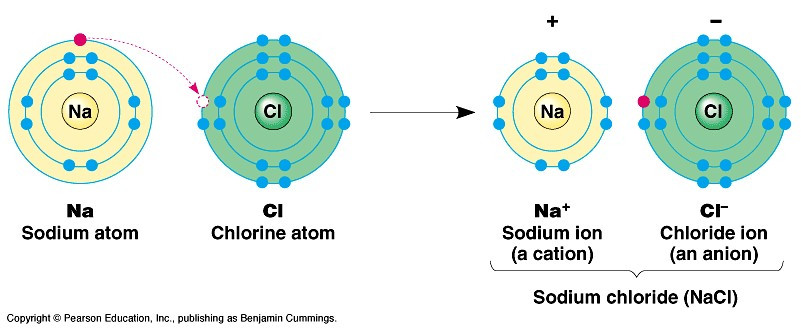
+ Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử sodium chloride:
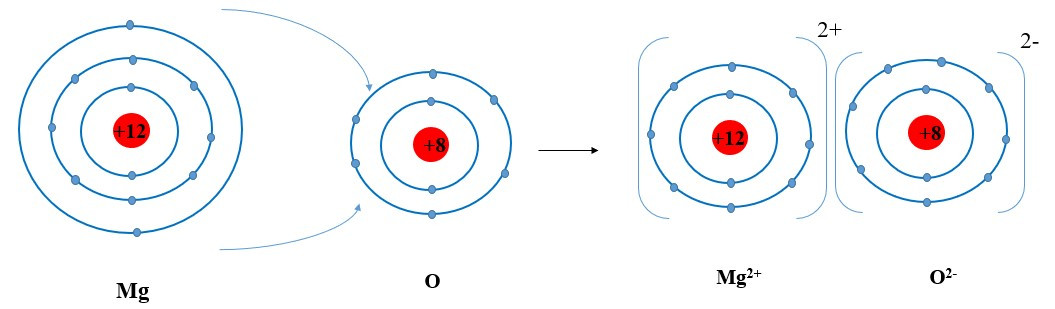
Ví dụ 2: Sự tạo thành liên kết trong phân tử magnesium oxide
+ Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu Mg2+:
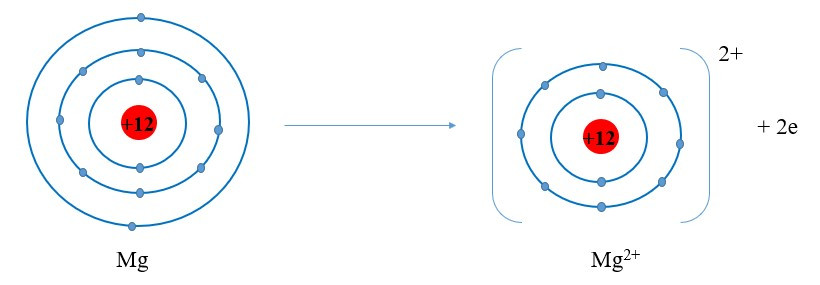
+ Nguyên tử O nhận 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích âm, kí hiệu là O2-:
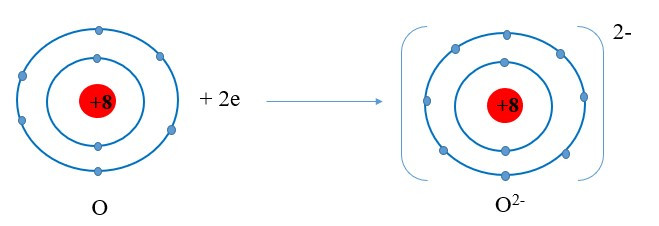
+ Các ion Mg2+ và O2- hút nhau tạo thành liên kết trong phân tử magnesium oxide:
2. Tính chất chung của hợp chất ion
+ Là chất rắn ở điều kiện thường.
Ví dụ: potassium chloride, copper oxide,…
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Ví dụ: aluminium oxide, sodium chloride, copper oxide,…
+ Khi tan trong nước tạo ra dung dịch dẫn điện.
Ví dụ: sodium chloride, magnesium chloride,…

III. Liên kết cộng hóa trị
1. Sự tạo thành liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử.
- Chất được tạo thành nhờ liên kết cộng hóa trị giữa các nguyên tử được gọi là chất cộng hóa trị.
- Để có lớp vỏ electron bền vững tương tự khí hiếm, các nguyên tử phi kim sẽ góp các electron để tạo ra một hoặc nhiều đôi electron dùng chung giữa các nguyên tử và liên kết với nhau thành phân tử.
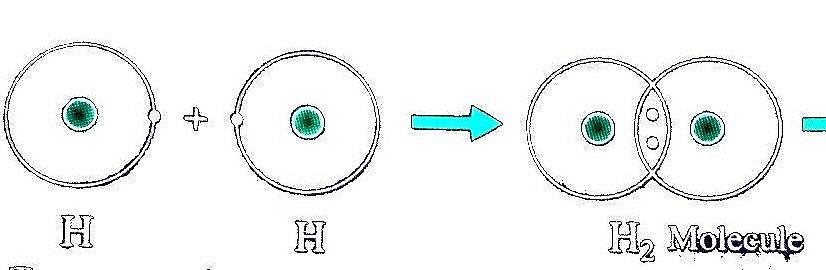
Ví dụ 1: Sự tạo thành liên kết trong phân tử hydrogen
+ Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thanh phân tử hydrogen. Liên kết như này được gọi là liên kết cộng hóa trị.
Ví dụ 2: Sự tạo thành liên kết trong phân tử nước
+ Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron. Giữa nguyên tử O và nguyên tử H có 1 electron dùng chung.
+ Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước.
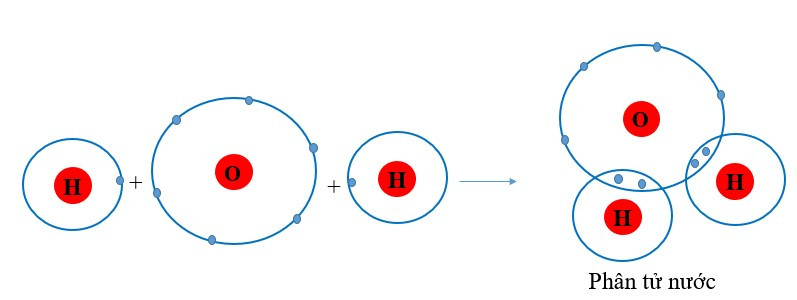
2. Một số đặc điểm của chất cộng hóa trị
+ Có cả ba thể: thế rắn (đường ăn, iodine,…), thể lỏng (bromine, ethanol,…), thể khí (oxygen, nitrogen, khí carbonic,…).
+ Các chất cộng hóa trị thường có nhiệt độ sôi và nhiệt độ nóng chảy thấp.
+ Nhiều chất cộng hóa trị không dẫn điện (đường ăn, ethanol,…).