Với giải Câu hỏi 4 trang 35 Khoa học tự nhiên lớp 7 Cánh diều chi tiết trong Bài 5: Giới thiệu về liên kết hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học
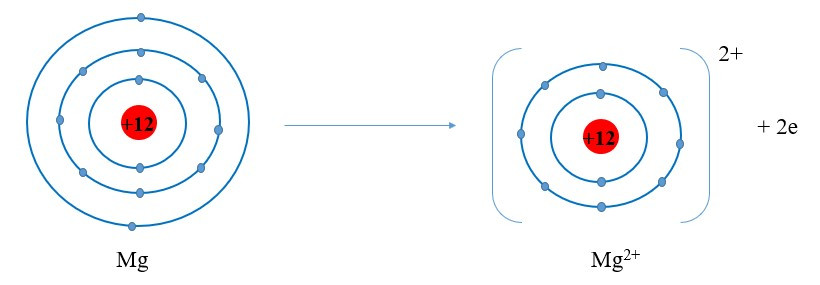
Câu hỏi 4 trang 35 KHTN lớp 7: Quan sát các hình 5.5 và 5.6, cho biết các ion Mg2+ và O2- có lớp vỏ tương tự khí hiếm nào
Phương pháp giải:
Đếm số electron ở lớp vỏ và số lớp electron của ion Mg2+, O2-
Trả lời:
- Xét ion Mg2+:
+ Có 10 hình cầu màu xanh ở các đường => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Mg2+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion O2-
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion O2- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
Lý thuyết Liên kết ion
1. Sự tạo thành liên kết ion
- Liên kết ion là liên kết được tạo thành bởi lực hút giữa ion dương và ion âm. Chất được tạo thành các ion dương và ion âm được gọi là hợp chất ion.
- Khi kim loại điển hình kết hợp với phi kim điển hình, nguyên tử kim loại sẽ cho electron tạo thành ion dương, nguyên tử phi kim sẽ nhận electron tạo thành ion âm. Các ion âm và ion dương hút nhau, tạo ra hợp chất ion.
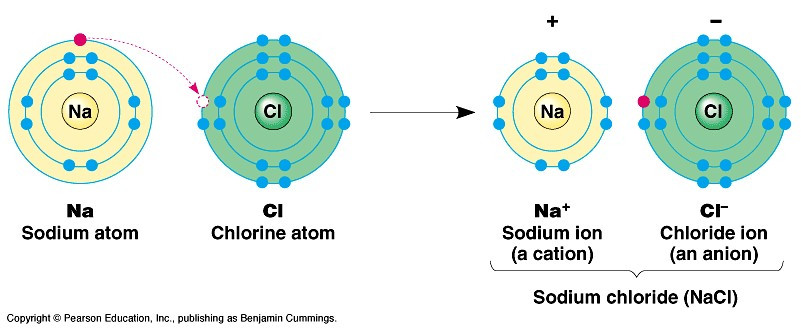
Ví dụ 1: Sự tạo thành liên kết trong phân tử sodium chloride:
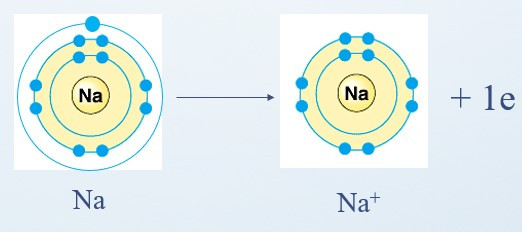
+ Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+:
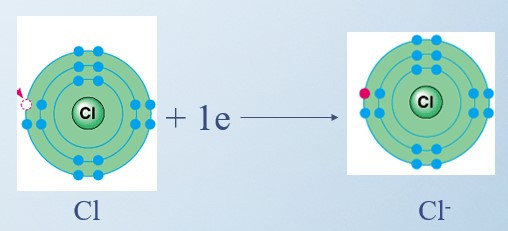
+ Nguyên tử Cl nhận 1 electron ở lớp ngoài cùng trở thành ion mang điện tích âm, kí hiệu là Cl-
+ Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử sodium chloride:
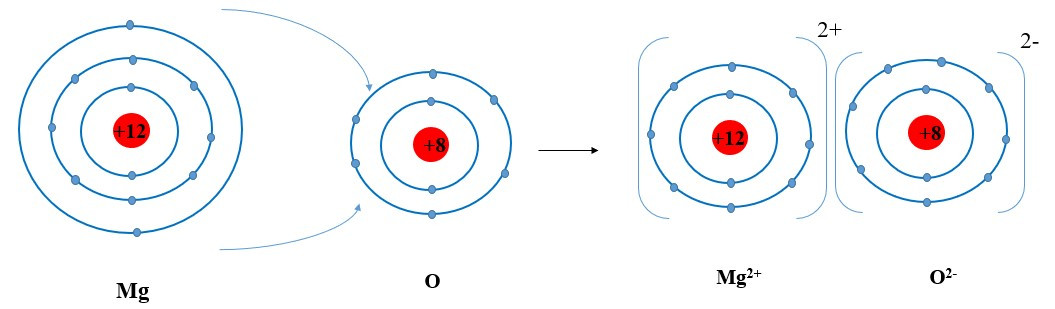
Ví dụ 2: Sự tạo thành liên kết trong phân tử magnesium oxide
+ Nguyên tử Mg cho đi 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu Mg2+:
+ Nguyên tử O nhận 2 electron ở lớp ngoài cùng trở thành ion mang hai điện tích âm, kí hiệu là O2-:
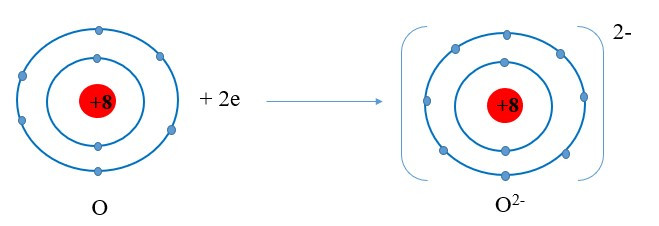
+ Các ion Mg2+ và O2- hút nhau tạo thành liên kết trong phân tử magnesium oxide:
2. Tính chất chung của hợp chất ion
+ Là chất rắn ở điều kiện thường.
Ví dụ: potassium chloride, copper oxide,…
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Ví dụ: aluminium oxide, sodium chloride, copper oxide,…
+ Khi tan trong nước tạo ra dung dịch dẫn điện.
Ví dụ: sodium chloride, magnesium chloride,…

Xem thêm các bài giải Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Luyện tập 4 trang 36 KHTN lớp 7: Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine...
Vận dụng trang 38 KHTN lớp 7: Hãy giải thích các hiện tượng sau:...
Câu hỏi 9 trang 38 KHTN lớp 7: So sánh một số tính chất chung của chất cộng hóa trị với chất ion...
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất
Bài 5: Giới thiệu về liên kết hóa học
Bài 6: Hóa trị, công thức hóa học