Với giải sách bài tập Hoá học 10 Bài 21: Nhóm halogen sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 21: Nhóm halogen
Nhận biết
Bài 21.1 trang 65 SBT Hóa học 10: Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là
A. 5
B. 7
C. 2
D. 8
Lời giải
Đáp án đúng là: B
Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là 7
Bài 21.2 trang 65 SBT Hóa học 10: Tính chất hóa học đặc trưng của các đơn chất halogen là
A. tính khử
B. tính base
C. tính acid
D. tính oxi hóa
Lời giải
Đáp án đúng là: D
Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là 7. Do đó, nguyên tử nguyên tố halogen có xu hướng nhận thêm 1 electron để đạt cấu hình bền vững của khí hiếm theo quy tắc octet khi hình thành liên kết hóa học.
⇒ Tính chất hóa học đặc trưng của các đơn chất halogen là tính oxi hóa.
Bài 21.3 trang 65 SBT Hóa học 10: Trong tự nhiên, nguyên tố fluorine tồn tại phổ biến nhất ở dạng hợp chất là
A. Na3AlF6
B. NaF
C. HF
D. CaF2
Lời giải
Đáp án đúng là: D
Trong tự nhiên, nguyên tố fluorine tồn tại phổ biến nhất ở dạng hợp chất là CaF2
Bài 21.4 trang 65 SBT Hóa học 10: Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là
A. F2
B. Br2
C. I2
D. Cl2
Lời giải
Đáp án đúng là: D
Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là I2.
Chú ý: Ở điều kiện thường
F2 dạng khí màu lục nhạt
Cl2 dạng khí màu vàng lục
Br2 dạng lỏng màu nâu đỏ
Bài 21.5 trang 65 SBT Hóa học 10: Muối nào có nhiều nhất trong nước biển với nồng độ khoảng 3%?
A. NaCl
B. KCl
C. MgCl2
D. NaF
Lời giải
Đáp án đúng là: A
Muối có nhiều nhất trong nước biển với nồng độ khoảng 3% là NaCl.
Bài 21.6 trang 65 SBT Hóa học 10: Số oxi hóa cao nhất mà nguyên tử chlorine thể hiện được trong các hợp chất là
A. -1
B. +7
C. +5
D. +1
Lời giải
Đáp án đúng là: B
Số oxi hóa cao nhất mà nguyên tử chlorine thể hiện được trong các hợp chất là +7
Bài 21.7 trang 65 SBT Hóa học 10: Các nguyên tố halogen thuộc nhóm nào trong bảng tuần hoàn?
A. VIIIA
B. VIA
C. VIIA
D. IIA
Lời giải
Đáp án đúng là: C
Các nguyên tố halogen thuộc nhóm VIIA trong bảng tuần hoàn.
Bài 21.8 trang 65 SBT Hóa học 10: Trong nhóm halogen, đơn chất có tính oxi hóa mạnh nhất là
A. F2
B. Cl2
C. Br2
D. I2
Lời giải
Đáp án đúng là: A
Trong nhóm halogen, đơn chất có tính oxi hóa mạnh nhất là F2. Vì F2 có độ âm điện lớn nhất nên lực hút giữa hạt nhân với electron lớp ngoài cùng là lớn nhất.
Bài 21.9 trang 65 SBT Hóa học 10: Khi đun nóng, chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là
A. F2
B. Cl2
C. Br2
D. I2
Lời giải
Đáp án đúng là: D
Khi đun nóng, chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là I2
Bài 21.10 trang 65 SBT Hóa học 10: Halogen nào sau đây được dùng để khử trùng nước sinh hoạt?
A. F2
B. Cl2
C. Br2
D. I2
Lời giải
Đáp án đúng là: B
Halogen được dùng để khử trùng nước sinh hoạt là Cl2
Bài 21.11 trang 65 SBT Hóa học 10: Trong cơ thể người, nguyên tố iodine tập trung ở tuyến nào sau đây?
A. Tuyến thượng thận.
B. Tuyến tụy
C. Tuyến yên.
D. Tuyến giáp trạng.
Lời giải
Đáp án đúng là: D
Trong cơ thể người, nguyên tố iodine tập trung ở tuyến giáp trạng.
Bài 21.12 trang 65 SBT Hóa học 10: Trong dãy halogen, nguyên tử có độ âm điện nhỏ nhất là
A. fluorine
B. chlorine
C. bromine
D. iodine
Lời giải
Đáp án đúng là: D
Trong dãy halogen, nguyên tử có độ âm điện nhỏ nhất là iodine
Thông hiểu
Bài 21.13 trang 66 SBT Hóa học 10: Trong nhóm halogen, từ fluorine đến iodine, bán kính nguyên tử biến đổi như thế nào?
A. Giảm dần
B. Không đổi
C. Tăng dần
D. Tuần hoàn
Lời giải
Đáp án đúng là: C
Trong nhóm halogen, từ fluorine đến iodine, bán kính nguyên tử tăng dần do số lớp electron tăng dần.
Bài 21.14 trang 66 SBT Hóa học 10: Trong nhóm halogen, nguyên tử nguyên tố thể hiện khuynh hướng nhận 1 electron yếu nhất là
A. fluorine
B. chlorine
C. bromine
D. iodine
Lời giải
Đáp án đúng là: D
Trong nhóm halogen, nguyên tử nguyên tố thể hiện khuynh hướng nhận 1 electron yếu nhất là iodine.
Bài 21.15 trang 66 SBT Hóa học 10: Trong nhóm halogen, từ fluorine đến iodine, nhiệt độ nóng chảy biến đổi như thế nào?
A. Giảm dần
B. Tăng dần
C. Không đổi.
D. Tuần hoàn.
Lời giải
Đáp án đúng là: B
Trong nhóm halogen, tương tác van der Waals tăng theo sự tăng của số electron trong phân tử.
⇒ Từ fluorine đến iodine, nhiệt độ nóng chảy tăng dần.
Bài 21.16 trang 66 SBT Hóa học 10: Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là
A. F2
B. Cl2
C. Br2
D. I2
Lời giải
Đáp án đúng là: A
Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là F2
Bài 21.17 trang 66 SBT Hóa học 10: Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nào sau đây?
A. Nhường 1 electron
B. Nhận 1 electron.
C. Nhường 7 electron
D. Góp chung 1 electron.
Lời giải
Đáp án đúng là: B
Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nhận 1 electron.
Bài 21.18 trang 66 SBT Hóa học 10: Hít thở không khí có chứa khí nào sau đây vượt ngưỡng 30 μg/m3 không khí (QCVN 06:2009/BTNMT) sẽ tiềm ẩn nguy cơ gây viêm đường hô hấp, co thắt phế quản, khó thở?
A. O2
B. Cl2
C. N2
D. O3
Lời giải
Đáp án đúng là: B
Hít thở không khí có chứa khí Cl2 vượt ngưỡng 30 μg/m3 không khí (QCVN 06:2009/BTNMT) sẽ tiềm ẩn nguy cơ gây viêm đường hô hấp, co thắt phế quản, khó thở
Bài 21.19 trang 66 SBT Hóa học 10: Quá trình sản xuất khí chlorine trong công nghiệp hiện nay dựa trên phản ứng nào sau đây?
A. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
B. Cl2 + 2NaBr → 2NaCl + Br2
C. 2NaCl + 2H2O 2NaOH + Cl2 + H2
D. 2NaOH + Cl2 → NaCl + NaClO + H2O
Lời giải
Đáp án đúng là: C
Quá trình sản xuất khí chlorine trong công nghiệp hiện nay dựa trên phản ứng điện phân dung dịch muối ăn có màng ngăn.
2NaCl + 2H2O 2NaOH + Cl2 + H2
Bài 21.20 trang 66 SBT Hóa học 10: Chỉ thị nào sau đây thường dùng để nhận biết dung dịch I2?
A. Phenolphtalein.
B. Hồ tinh bột
C. Quỳ tím
D. Nước vôi trong
Lời giải
Đáp án đúng là: B
Chỉ thị thường dùng để nhận biết dung dịch I2 là hồ tinh bột.
Hiện tượng: Dung dịch chuyển màu xanh tím.
Vận dụng
Bài 21.21 trang 67 SBT Hóa học 10: Thực nghiệm cho thấy các phản ứng:
H2(g) + X2(g) → 2HX(g) trong dãy halogen xảy ra với mức độ giảm dần từ F2 đến I2.
Biến thiên enthalpy của các phản ứng thay đổi như thế nào trong dãy trên?
Lời giải
F2 tác dụng với H2 mạnh nhất nên phản ứng: H2(g) + F2(g) → 2HF(g)
có biến thiên enthalpy âm nhất.
I2 tác dụng với H2 yếu nhất nên phản ứng: H2(g) + I2(g) → 2HI(g)
Có biến thiên enthalpy ít âm nhất.
Như vậy, biến thiên enthalpy của các phản ứng tăng dần trong dãy trên.
Lời giải
Áp dụng định luật bảo toàn khối lượng, ta có:
= 1,332 – 0,48 = 0,825 (g)
⇒
Phương trình hóa học:
⇒ M là Ca.
Bài 21.23 trang 67 SBT Hóa học 10: Nung nóng một bình bằng thép có chứa 0,04 mol H2 và 0,04 mol Cl2 để thực hiện phản ứng, thu được 0,072 mol khí HCl.
a) Tính hiệu suất của phản ứng tạo thành HCl.
Lời giải
a) Phương trình hóa học:
Hiệu suất phản ứng là:
b) Phản ứng có số mol khí hai vế bằng nhau nên tổng số mol khí trước và sau phản ứng bằng nhau, dẫn tới áp suất bằng nhau: P1 = P2.
Lời giải
Hiện tượng hồ tinh bột chuyển màu xanh tím chứng tỏ sau phản ứng ống thứ hai có sinh ra I2 nên muối X là KI.
Khi cho AgNO3 và thu được kết tủa màu vàng của AgI
Phương trình hóa học của các phản ứng:
KI + AgNO3 → KNO3 + AgI↓
2KI + Br2 → 2KBr + I2
Bài 21.25 trang 67 SBT Hóa học 10: Trong phòng thí nghiệm, khí chlorine được điều chế, làm khô và thu vào bình theo sơ đồ dưới đây.
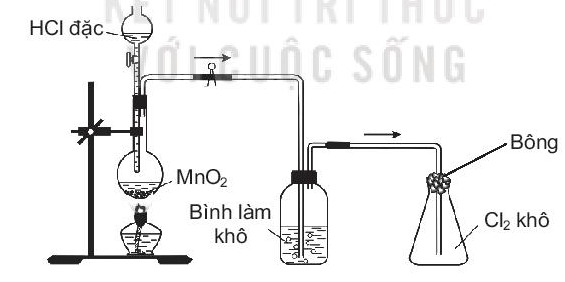
Hãy đề xuất một dung dịch để sử dụng cho từng mục đích sau:
a) Cho vào bình làm khô để làm khô khí Cl2.
b) Tẩm vào bông đậy bình thu khí để hạn chế khí Cl2 bay ra.
Giải thích và viết phương trình hóa học minh họa nếu có.
Lời giải
a) Dung dịch hút ẩm cần có khả năng hút nước và không tác dụng với chất cần làm khô là Cl2, do vậy không chọn dung dịch có tính kiềm. Đề xuất chọn dung dịch H2SO4 đặc.
b) Để hạn chế khí Cl2 bay ra cần chọn dung dịch có tính kiềm để tẩm vào bông đậy ở miệng bình thu khí. Đề xuất chọn dung dịch NaOH 4%.
Xem thêm các bài giải SBT Hoá học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide
Lý thuyết Nhóm halogen
I. Trạng thái tự nhiên
Nhóm VIIA (nhóm halogen) trong bảng tuần hoàn gồm sáu nguyên tố: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), astatine (At) và tennessine (Ts). Bốn nguyên tố F, Cl, Br và I tồn tại trong tự nhiên, còn At và Ts là các nguyên tố phóng xạ.
Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide.
Ví dụ:
Trong cơ thể người, nguyên tố chlorine có trong máu và dịch dạ dày (ở dạng ion Cl-), nguyên tố iodine có ở tuyến giáp (ở dạng hợp chất hữu cơ),
Rong biển chứa nguyên tố iodine.
II. Cấu tạo nguyên tử, phân tử
- Cấu tạo nguyên tử
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e ns2np6
Do vậy, số oxi hóa đặc trưng của các halogen trong hợp chất là –1.
Chú ý: Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hóa dương: +1, +3, +5, +7 (trừ fluorine có độ âm điện lớn nhất, nên fluorine luôn có số oxi hóa bằng –1 trong mọi hợp chất).
- Cấu tạo phân tử
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2, liên kết hóa học trong phân tử X2 là liên kết cộng hóa trị không phân cực.
Ví dụ: F2, Cl2, Br2, I2.
III. Tính chất vật lí
Trạng thái tồn tại, màu sắc, nhiệt độ nóng chảy (tnc), nhiệt độ sôi (ts) của halogen:
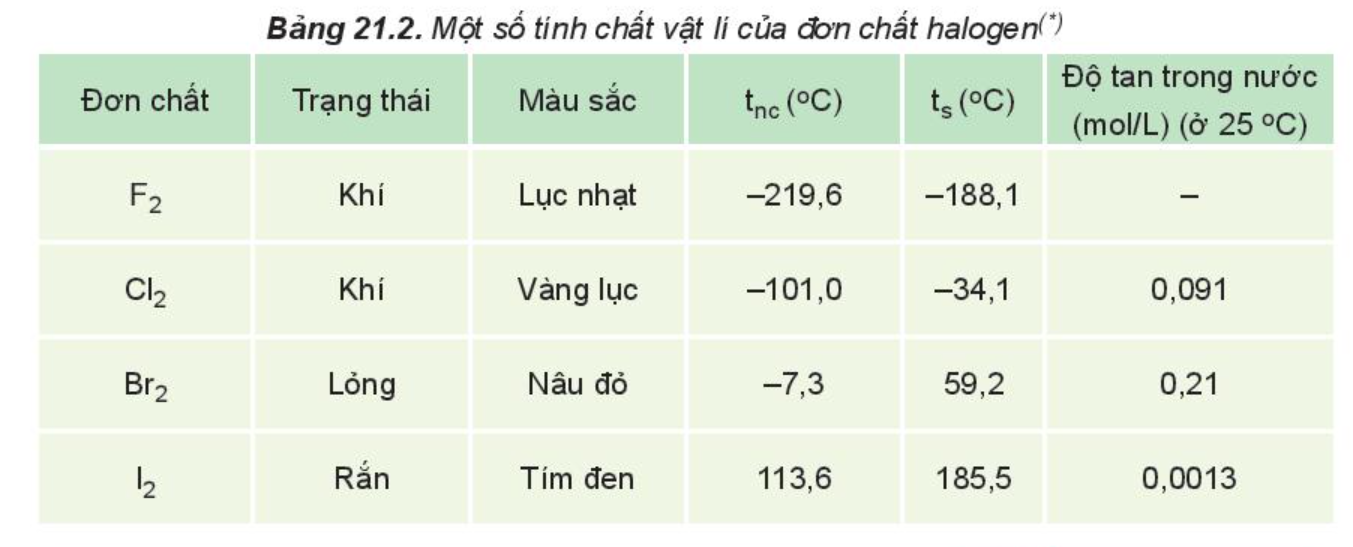
Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Ở điều kiện thường, các halogen ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene. Trong y học, dung dịch iodine loãng trong ethanol được dùng làm thuốc sát trùng.
Bromine gây bỏng sâu khi tiếp xúc với da. Hít thở không khí có chứa halogen với nồng độ vượt ngưỡng cho phép làm tổn hại niêm mạc tế bào đường hô hấp, gây co thắt phế quản, khó thở.
IV. Tính chất hóa học
Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
1. Tác dụng với kim loại
Các halogen phản ứng trực tiếp với nhiều kim loại, tạo muối halide.
Ví dụ:
2. Tác dụng với hydrogen
Các halogen phản ứng với hydrogen, tạo thành hydrogen halide.

Nhận xét: Mức độ phản ứng của các halogen với hydrogen giảm dần khi đi từ fluorine đến iodine, phù hợp với tính oxi hóa của các halogen giảm dần từ F2 đến I2.
3. Tác dụng với nước
F2 phản ứng mạnh với nước ngay ở nhiệt độ thường, giải phóng khí O2:
2F2 + 2H2O 4HF + O2
Các halogen Cl2, Br2 và I2 phản ứng chậm với nước và mức độ phản ứng giảm dần từ Cl2 đến I2.
Ví dụ: .
Nhận xét:
Số oxi hóa của nguyên tố chlorine vừa tăng lên +1, vừa giảm xuống –1 nên Cl2 vừa là chất oxi hóa, vừa là chất khử.
Hypochlorous (HClO) có tính oxi hóa mạnh nên chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt.
4. Tác dụng với dung dịch kiềm
Chlorine phản ứng với dung dịch sodium hydroxide ở điều kiện thường, tạo thành nước Javel (Gia-ven):
Cl2 + 2NaOH NaCl + NaClO + H2O
Nước Javel (chứa NaClO (sodium hypochlorite), NaCl và một phần NaOH dư) được dùng làm chất tẩy rửa, khử trùng.
Chú ý: Khi đun nóng, Cl2 phản ứng với dung dịch potassium hydroxide tạo thành muối chlorate.
3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
Potassium choratelà chất oxi hóa mạnh, được sử dụng chế tạo thuốc nổ, hỗn hợp đầu que diêm, …
5. Tác dụng với dung dịch halide
Chlorine có thể oxi hóa ion Br- trong dung dịch muối bromide và ion I- trong dung dịch muối iodine; bromine có thể oxi hóa ion I- trong dung dịch muối iodine.
Ví dụ:
Cl2 + 2NaBr 2NaCl + Br2
Br2 + 2NaI 2NaBr + I2
V. Điều chế chlorine
1. Trong phòng thí nghiệm
Cho quặng pyrolusite (MnO2) tác dụng với hydrochloric acid đặc:
MnO2 + 4HCl(đặc) MnCl2 + Cl2 + 2H2O
Ngoài ra, còn có thể thay MnO2 bằng KMnO4 rắn để điều chế khí Cl2:
2KMnO4 + 16HCl(đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2. Trong công nghiệp
Chlorine được sản xuất ở nhiệt độ thường bằng cách điện phân dung dịch muối ăn bão hòa, có màng ngăn giữa các điện cực:
2NaCl + 2H2O 2NaCl + H2 + Cl2