Lời giải bài tập Hóa học lớp 10 Bài 21: Nhóm halogen sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 21 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 21: Nhóm halogen
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh họa
Phương pháp giải:
- NaCl: liên kết ion
- HCl: Liên kết cộng hóa trị
Lời giải:
- Sự hình thành liên kết trong phân tử NaCl: Nguyên tử chlorine đã nhận 1 electron của nguyên tử sodium để tạo thành Na+ và Cl-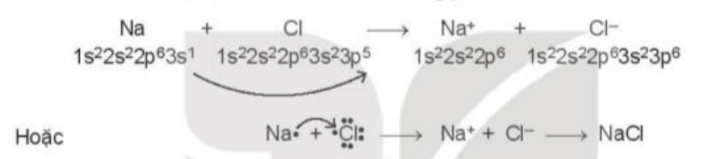
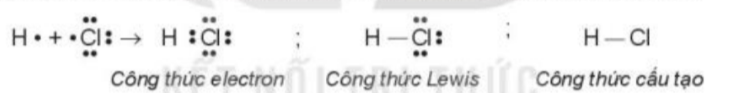
- Sự hình thành liên kết trong phân tử HCl: Mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl
Lý thuyết Cấu tạo nguyên tử, phân tử
- Cấu tạo nguyên tử
Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e ns2np6
Do vậy, số oxi hóa đặc trưng của các halogen trong hợp chất là –1.
Chú ý: Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hóa dương: +1, +3, +5, +7 (trừ fluorine có độ âm điện lớn nhất, nên fluorine luôn có số oxi hóa bằng –1 trong mọi hợp chất).
- Cấu tạo phân tử
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2, liên kết hóa học trong phân tử X2 là liên kết cộng hóa trị không phân cực.
Ví dụ: F2, Cl2, Br2, I2.
Xem thêm lời giải bài tập Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: