Lời giải bài tập Khoa học tự nhiên lớp 7 Bài 7: Hóa trị và công thức hóa học sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi KHTN 7 Bài 7 từ đó học tốt môn Khoa học tự nhiên 7.
Giải bài tập KHTN lớp 7 Bài 7: Hóa trị và công thức hóa học
Video giải KHTN 7 Bài 7: Hóa trị và công thức hóa học - Kết nối tri thức
Trả lời:
Trong công thức hóa học của hợp chất hai nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia
1. Công thức hóa học
Phương pháp giải:
- Số nguyên tử của từng nguyên tố = chỉ số ở chân bên phải kí hiệu hóa học
- Cách xác định phần trăm khối lượng của nguyên tố trong hợp chất
Bước 1: Tính khối lượng phân tử hợp chất
Bước 2: Tính phần trăm khối lượng các nguyên tố trong hợp chất:
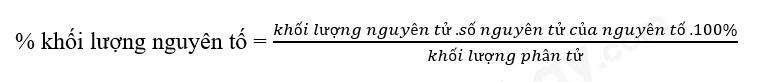
Trả lời:
- Trong 1 phân tử copper sulfate (CuSO4) gồm 3 nguyên tố: Cu, S, O trong đó có:
+ 1 nguyên tử Cu (copper)
+ 1 nguyên tử S (sulfur)
+ 4 nguyên tử O (oxygen)
- Xác định phần trăm khối lượng của các nguyên tố:
Bước 1: Khối lượng phân tử CuSO4 = 64.1 + 32.1 + 16.4 = 160 amu
Bước 2: Phần trăm khối lượng các nguyên tố trong CuSO4

2. Hóa trị
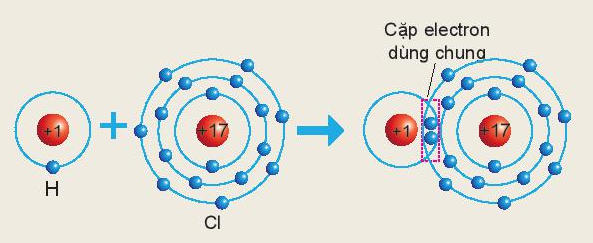
Câu hỏi trang 42 KHTN lớp 7: Sơ đồ sau mô tả sự hình thành liên kết cộng hóa trị trong phân tử HCl:
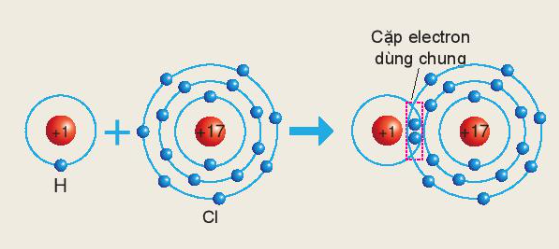
Xác định hóa trị của chlorine trong hợp chất trên
Phương pháp giải:
Hóa trị của nguyên tố được xác định bằng số cặp electron dùng chung của nguyên tử nguyên tố đó với nguyên tử khác
Trả lời:
Hydrogen và chlorine bỏ ra 1 electron
=> Một cặp electron dùng chung
=> Chlorine có hóa trị I trong hợp chất HCl
Hoạt động trang 42 KHTN lớp 7: Tìm hiểu về quy tắc hóa trị
Thảo luận nhóm, hoàn thành bảng mẫu và thực hiện các yêu cầu sau:

1. Xét phân tử H2S, hãy so sánh tích của chỉ số và hóa trị của nguyên tố lưu huỳnh với tích chỉ số và hóa trị của nguyên tố hydrogen
2. Đối với phân tử CH4, thực hiện tương tự như với phân tử H2S. Em hãy so sánh về tích của chỉ số và hóa trị của các nguyên tố thành phần
Phương pháp giải:
Trong công thức hóa học của hợp chất hai nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia
Trả lời:
Trong CH4, nguyên tử C liên kết với 4 nguyên tử H => C có hóa trị IV
|
|
Hóa trị của lưu huỳnh/ carbon |
Tích của chỉ số và hóa trị của lưu huỳnh/ carbon |
Tích của chỉ số và hóa trị của hydrogen |
|
H2S |
II |
1 x II |
2 x I |
|
CH4 |
IV |
1 x IV |
4 x I |
1.
Ta có: 1 x II = 2 x I = II
=> Tích của chỉ số và hóa trị của nguyên tố lưu huỳnh = tích chỉ số và hóa trị của nguyên tố hydrogen
2.
Ta có: 1 x IV = 4 x I = IV
=> Tích của chỉ số và hóa trị của nguyên tố carbon = tích chỉ số và hóa trị của nguyên tố hydrogen
Phương pháp giải:
- Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì nguyên tố đó có hóa trị bằng bấy nhiêu
- Xác định hóa trị của S trong hợp chất sulfur dioxide tương tự với phân tử carbon dioxide
Trả lời:
- Xét phân tử sulfur dioxide:
+ Nguyên tử O có hóa trị II
+ 1 nguyên tử S liên kết với 2 nguyên tử O
=> S có hóa trị IV
- Xét phân tử hydrogen sulfide:
+ H có hóa trị I
+ 1 nguyên tử S liên kết với 2 nguyên tử H.
+ Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì nguyên tố đó có hóa trị bằng bấy nhiêu
=> S có hóa trị II
Trả lời:
Hợp chất methane:
+ H có hóa trị I
+ 1 nguyên tử C liên kết với 4 nguyên tử H
+ Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì nguyên tố đó có hóa trị bằng bấy nhiêu
=> C có hóa trị IV
Phương pháp giải:
Quy tắc hóa trị: Trong công thức hóa học của hợp chất 2 nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia
Trả lời:
Potassium oxide bao gồm 2 nguyên tố: K và O. Trong đó:
+ K có hóa trị I
+ O có hóa trị II
- Gọi công thức hóa học tổng quát của potassium oxide là: KxOy
- Áp dụng quy tắc hóa trị. Ta có: x.I = y.II
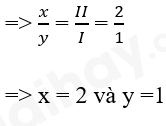
=> Công thức hóa học của potassium oxide là K2O
3. Lập công thức hóa học của hợp chất
Phương pháp giải:
Gọi công thức phân tử của carbon dioxide là CxOy
Ta có: 12.x + 16.y = 44
Cứ 1 phần khối lượng carbon có tương ứng 2,667 phần khối lượng oxygen nghĩa là:
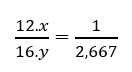
=> Tìm được x và y
Trả lời:
- Khí carbon dioxide bao gồm 2 nguyên tố: C và O
- Gọi công thức phân tử của carbon dioxide là CxOy
- Vì khối lượng phân tử của carbon dioxide là 44 amu
=> 12.x + 16.y = 44 => 12x = 44 -16 (1)
- Cứ 1 phần khối lượng carbon có tương ứng 2,667 phần khối lượng oxygen nghĩa là:
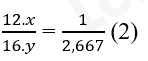
Thay 12x ở phương trình (1) vào phương trình (2)
=> y = 2 và x = 1
=> Công thức hóa học của carbon dioxide là CO2
Phương pháp giải:
Gọi công thức phân tử của khí hydrogen sulfide là HxSy
- S có hóa trị II, H có hóa trị I
- Theo quy tắc hóa trị: x.I = y.II
=> Tìm ra x và y
Trả lời:
- Khí hydrogen sulfide bao gồm 2 nguyên tố: H và S
- Gọi công thức phân tử của khí hydrogen sulfide là HxSy
- S có hóa trị II, H có hóa trị I
- Theo quy tắc hóa trị: x.I = y.II
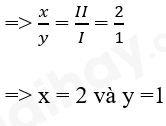
=> Công thức hóa học của hydrogen sulfide là H2S
Lý thuyết KHTN 7 Bài 7: Hóa trị và công thức hóa học
I. Công thức hóa học
1. Khái niệm
- Công thức hóa học của một chất là cách biểu diễn chất bằng kí hiệu hóa học của nguyên tố kèm theo chỉ số ở chân bên phải của kí hiệu hóa học.
Ví dụ: Công thức hóa học của oxygen là O2; công thức hóa học của carbon dioxide là CO2.
2. Cách viết công thức hóa học
a) Công thức hóa học của đơn chất
- Đối với các đơn chất được tạo thành từ nguyên tố kim loại, khí hiếm và một số phi kim thì kí hiệu hóa học của nguyên tố được coi là công thức hóa học.
Ví dụ: Công thức hóa học của đồng là Cu, sắt là Fe, helium là He, carbon là C, lưu huỳnh là S, …
- Một số phi kim có phân tử gồm hai hay ba nguyên tử liên kết với nhau thì thêm chỉ số này ở chân bên phải kí hiệu hóa học.
Ví dụ: Công thức hóa học của hydrogen là H2; oxygen là O2; ozone là O3…
b) Công thức hóa học của hợp chất:
- Công thức hóa học của hợp chất gồm kí hiệu hóa học của những nguyên tố tạo ra hợp chất kèm theo chỉ số ở chân bên phải kí hiệu hóa học.
- Chỉ số là những số nguyên, cho biết số nguyên tử của mỗi nguyên tố trong hợp chất, chỉ số bằng 1 thì không ghi.
Ví dụ: Công thức hóa học của khí methane là CH4, của muối ăn là NaCl.
3. Ý nghĩa của công thức hóa học
- Công thức hóa học cho biết:
+ Các nguyên tố hóa học tạo nên chất.
+ Số nguyên tử hay tỉ lệ số nguyên tử của các nguyên tố hóa học có trong phân tử.
+ Khối lượng phân tử của chất.
Ví dụ: Công thức hóa học của calcium carbonate CaCO3 cho biết:
+ Calcium carbonate gồm 3 nguyên tố là Ca, C và O.
+ Trong một phân tử calcium carbonate có một nguyên tử Ca, một nguyên tử C, ba nguyên tử O và tỉ lệ số nguyên tử Ca : C : O là 1 : 1 : 3.
+ Khối lượng phân tử bằng 40 + 12 + 3.16 = 100 amu.
- Biết công thức hóa học tính được phần trăm khối lượng của các nguyên tố trong hợp chất.
Bước 1: Tính khối lượng phân tử hợp chất.
Bước 2: Tính phần trăm khối lượng các nguyên tố trong hợp chất:

Ví dụ: Tính phần trăm khối lượng của các nguyên tố trong phân bón KNO3
Trong một phân tử KNO3 có một nguyên tử K, một nguyên tử N và ba nguyên tử O.
- Khối lượng phân tử KNO3 bằng: 39.1 + 14.1 + 16.3 = 101 (amu)
Phần trăm khối lượng các nguyên tố trong KNO3 là:
%O = 100% - 38,6% - 13,9% = 47,5%
II. Hóa trị
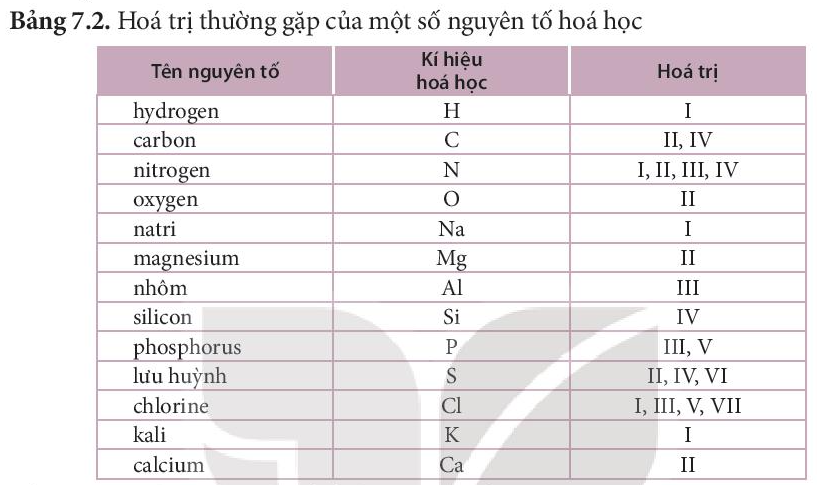
1. Khái niệm hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
- Trong hợp chất cộng hóa trị, hóa trị của nguyên tố được xác định bằng số cặp electron dùng chung của nguyên tử nguyên tố đó với nguyên tử nguyên tố khác.
Ví dụ 1: Trong phân tử nước, mỗi nguyên tử H có một cặp electron dùng chung với nguyên tử O nên H có hóa trị I; nguyên tử O có hai cặp electron dùng chung với hai nguyên tử H nên O có hóa trị II.
Ví dụ 2: Phân tử HCl gồm 1 nguyên tử Cl liên kết với 1 nguyên tử H. Trong đó nguyên tử Cl có 1 cặp electron dùng chung với nguyên tử H
⇒ Nguyên tử H và Cl đều có hóa trị I
2. Quy tắc hóa trị
- Quy tắc hóa trị: Trong công thức hóa học của hợp chất hai nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
Ví dụ 1: áp dụng quy tắc hóa trị ta có: 2.V = 5.II
Ví dụ 2: áp dụng quy tắc hóa trị ta có: 1.IV = 4.I
- Quy tắc hóa trị được vận dụng chủ yếu cho các hợp chất vô cơ.
- Người ta quy ước nguyên tố H luôn có hóa trị I. Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì có hóa trị là bấy nhiêu.
- Oxygen được quy ước có hóa trị II. Từ đó xác định được hóa trị của các nguyên tố khác trong hợp chất có chứa H hoặc O.
Ví dụ 1: Trong hợp chất HCl, 1 Cl liên kết với 1 H nên Cl có hóa trị I.
Ví dụ 2: Trong phân tử carbon dioxide (CO2), nguyên tử của nguyên tố C liên kết được với hai nguyên tử O nên có hóa trị IV.
- Hóa trị của nhóm nguyên tử được xác định tương tự như cách xác định hóa trị của nguyên tố.
Ví dụ: Trong phân tử sulfuric acid (H2SO4), nhóm (SO4) liên kết với 2 nguyên tử hydrogen nên có hóa trị II.

III. Lập công thức hóa học của hợp chất
1. Lập công thức hóa học của hợp chất khi biết hóa trị
- Các bước xác định:
+ Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát)
+ Bước 2: Lập biểu thức tính dựa vào quy tắc hóa trị, chuyển thành tỉ lệ các chỉ số nguyên tử.
+ Bước 3: Xác định số nguyên tử (những số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hóa học cần tìm.
Ví dụ: Lập công thức hóa học của hợp chất tạo bởi lưu huỳnh có hóa trị IV và oxygen
Hướng dẫn:
Bước 1: Đặt công thức hóa học của hợp chất là:
Bước 2: Theo quy tắc hóa trị: x.IV = y.II
Bước 3: Chọn x = 1 và y = 2.
Vậy công thức hóa học của hợp chất là SO2
2. Lập công thức hóa học của hợp chất theo phần trăm các nguyên tố
Các bước xác định:
Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát);
Bước 2: Tính khối lượng phân tử của hợp chất
Bước 3: Lập biểu thức tính phần trăm nguyên tố có trong hợp chất. Xác định số nguyên tử của mỗi nguyên tố và viết công thức hóa học cần tìm.
Ví dụ 1: Lập công thức hóa học của hợp chất tạo bởi carbon và hydrogen, biết phần trăm khối lượng của C, H lần lượt là 75%, 25% và khối lượng phân tử của hợp chất là 16 amu.
Hướng dẫn
Bước 1: Đặt công thức của hợp chất là: CxHy
Bước 2: Khối lượng phân tử của khí carbon dioxide là: 12.x + 1.y = 16 (1)
%C = ⇒ x = 1
%H = ⇒ y = 4
Vậy công thức của hợp chất là CH4
Mở rộng: Biết công thức hóa học, tính phần trăm khối lượng các nguyên tố trong hợp chất.
Bột thuốc muối chữa đau dạ dày có công thức hóa học là NaHCO3 (natri hydrocarbonat hay sodium hydrocarbonate). Tính thành phần phần trăm các nguyên tố có trong hợp chất trên?
Hướng dẫn
Khối lượng phân tử NaHCO3 bằng 23.1 + 1.1 + 12 + 16.3 = 84 amu
Phần trăm khối lượng các nguyên tố hóa học trong NaHCO3 là:
%Na =
%H =
%C =
%O = 100% - 27,38% - 1,19% - 14,29% = 57,14%
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Kết nối tri thức hay, chi tiết khác:
Bài 6: Giới thiệu về liên kết hóa học
Bài 10: Đồ thị quãng đường - thời gian