Với giải Câu hỏi 2 trang 26 Khoa học tự nhiên lớp 7 Kết nối tri thức với cuộc sống chi tiết trong Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên lớp 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Câu hỏi 2 trang 26 KHTN lớp 7: Sử dụng bảng tuần hoàn và cho biết kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử, khối lượng nguyên tử và số electron trong nguyên tử của các nguyên tố ở ô số 6, 11
Phương pháp giải:
Trả lời:
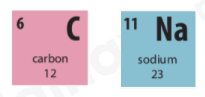
- Ô số 6:
+ Kí hiệu hóa học: C
+ Tên nguyên tố: Carbon
+ Số hiệu nguyên tử: 6
+ Khối lượng nguyên tử: 12
+ Số electron trong nguyên tử = số hiệu nguyên tử: 6
- Ô số 11:
+ Kí hiệu hóa học: Na
+ Tên nguyên tố: Sodium
+ Số hiệu nguyên tử: 11
+ Khối lượng nguyên tử: 23
+ Số electron trong nguyên tử = số hiệu nguyên tử: 12
Lý thuyết Cấu tạo bảng tuần hoàn các nguyên tố hóa học
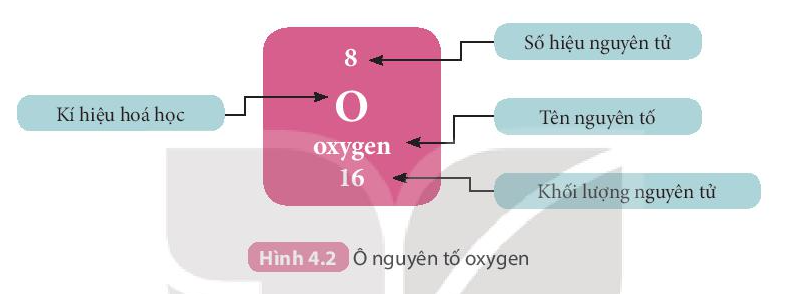
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô của bảng tuần hoàn, gọi là ô nguyên tố.
- Ô nguyên tố cho biết:
+ Kí hiệu hóa học.
+ Tên nguyên tố
+ Số hiệu nguyên tử
+ Khối lượng nguyên tử.
- Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số electron trong nguyên tử.
- Số hiệu nguyên tử chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Các thông tin về nguyên tố ở ô số 8 trong bảng tuần hoàn chi biết:
+ Kí hiệu hóa học: O
+ Tên nguyên tố: Oxygen
+ Số hiệu nguyên tử Z = 8
+ Khối lượng nguyên tử: 16 amu
Ngoài ra: Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số electron = số proton = 8
2. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần khi đi từ trái sang phải.
- Bảng tuần hoàn hiện nay gồm 7 chu kì được đánh số từ 1 đến 7, mỗi chu kì là một hàng ngang (riêng chu kì 6 và chu kì 7, mỗi chu kì có thêm 1 hàng xếp tách riêng ở cuối bảng).
+ Chu kì 1, 2, 3 được gọi là các chu kì nhỏ;
+ Chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
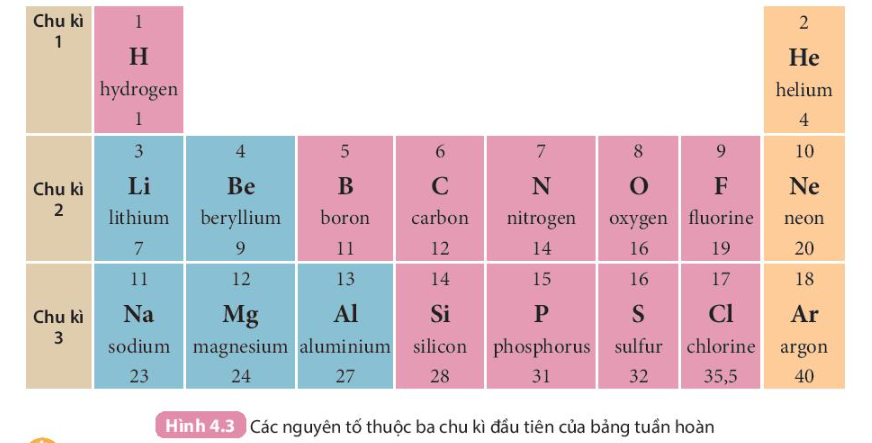
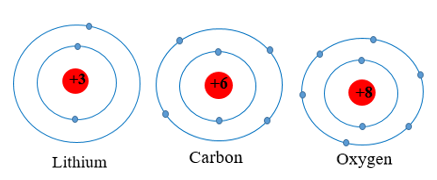
- Trong bảng tuần hoàn, số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
Ví dụ: Các nguyên tố lithium, carbon, oxygen thuộc chu kì 2 đều có 2 lớp electron trong nguyên tử.
3. Nhóm
- Bảng tuần hoàn gồm có 8 nhóm A được đánh só từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
- Các nguyên tố trong cùng một nhóm A có số electron ở lớp ngoài cùng bằng nhau (trừ trường hợp nguyên tố He), do vậy chúng có tính chất gần giống nhau.
Ví dụ: Nhóm IA gồm 7 nguyên tố từ H đến Fr. Các nguyên tố trong nhóm IA (trừ H) đều có 1 electron lớp ngoài cùng ⇒ Dễ nhường electron ⇒ Tính kim loại mạnh (nhóm các kim loại điển hình).
- Trong một nhóm, khi đi từ trên xuống dưới điện tích hạt nhân nguyên tử của các nguyên tố tăng dần.
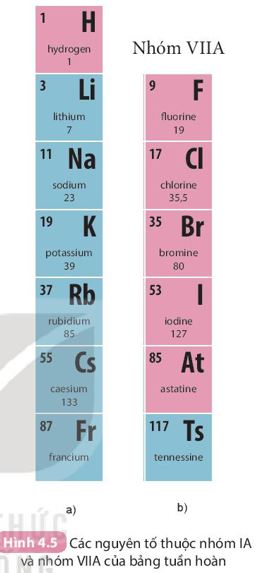
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm đó.
Ví dụ:
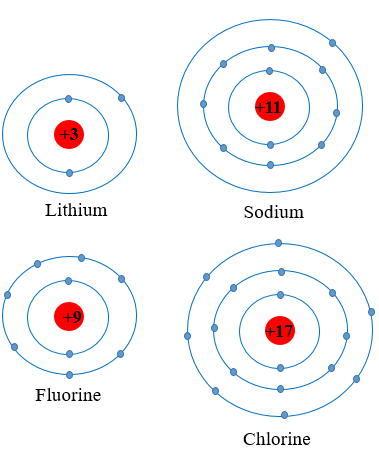
Nguyên tử các nguyên tố Li, Na cùng có 1 electron ở lớp ngoài cùng ⇒ thuộc nhóm IA trong bảng tuần hoàn.
Nguyên tử các nguyên tố F, Cl cùng có 7 electron ở lớp ngoài cùng ⇒ thuộc nhóm VIIA trong bảng tuần hoàn.
Mở rộng:
+ Một số nhóm có tên gọi riêng như: nhóm IA (nhóm kim loại kiềm); nhóm IIA (nhóm kim loại kiềm thổ); nhóm VIIA (nhóm halogen); nhóm VIIIA (nhóm khí hiếm).
+ Nguyên tố H có nhiều tính chất gần giống với nguyên tố nhóm VIIA; nên có thể được xếp ở vị trí đầu nhóm VIIA.
Xem thêm các bài giải Khoa học tự nhiên lớp 7 Kết nối tri thức hay, chi tiết khác:
Mở đầu trang 23 KHTN lớp 7: Ngày nay, người ta đã xác định được hàng chục triệu chất hóa học với các tính chất khác nhau được tạo thành từ hơn một trăm nguyên tố hóa học. Liệu có nguyên tắc nào sắp xếp các nguyên tố để dễ nhận ra tính chất của chúng không?...
Hoạt động 1 trang 23 KHTN lớp 7: Sắp xếp các nguyên tố hóa học...
Hoạt động 2 trang 23 KHTN lớp 7: Sắp xếp các nguyên tố hóa học...
Câu hỏi 2 trang 31 KHTN lớp 7: Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố:...
Câu hỏi 3 trang 31 KHTN lớp 7: Cho các nguyên tố sau:...
Xem thêm các bài giải SGK Khoa học tự nhiên lớp 7 Kết nối tri thức hay, chi tiết khác:
Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 5: Phân tử - Đơn chất - Hợp chất
Bài 6: Giới thiệu về liên kết hóa học
Bài 7: Hóa trị và công thức hóa học