Với giải sách bài tập Khoa học tự nhiên 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Khoa học tự nhiên 7. Mời các bạn đón xem:
Giải SBT Khoa học tự nhiên lớp 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lời giải:
Nhà bác học Men – đê – lê – ép là người nước Nga.
Các nguyên tố hóa học trong bảng tuần hoàn do ông xây dựng được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
a) Bảng tuần hoàn của Men – đê – lê – ép sắp xếp các nguyên tố theo chiều .. (1) .. nguyên tử.
b) Ngày nay, bảng tuần hoàn các nguyên tố hóa học sắp xếp các nguyên tố theo chiều ..(2).. nguyên tử. Các nguyên tố .. (3) .. có cùng số lớp electron trong nguyên tử, còn các nguyên tố .. (4) .. có tính chất gần giống nhau.
Lời giải:
a) Bảng tuần hoàn của Men – đê – lê – ép sắp xếp các nguyên tố theo chiều (1) tăng dần khối lượng nguyên tử.
b) Ngày nay, bảng tuần hoàn các nguyên tố hóa học sắp xếp các nguyên tố theo chiều (2) tăng dần điện tích hạt nhân nguyên tử. Các nguyên tố (3) cùng hàng có cùng số lớp electron trong nguyên tử, còn các nguyên tố (4) cùng cột có tính chất gần giống nhau.
Bài 4.3 trang 15 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây là đúng?
A. Bảng tuần hoàn gồm 116 nguyên tố hóa học.
B. Bảng tuần hoàn gồm 6 chu kì.
C. Bảng tuần hoàn gồm 8 nhóm A và 8 nhóm B.
D. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Lời giải:
Đáp án đúng là: C
A sai vì bảng tuần hoàn hiện tại có 118 nguyên tố hóa học.
B sai vì bảng tuần hoàn hiện tại có 7 chu kì.
D sai vì hiện tại các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
Lời giải:
- Nguyên tố ở ô số 3: Kí hiệu hóa học Li, tên nguyên tố lithium, số hiệu nguyên tử 3, khối lượng nguyên tử 7 amu.
- Nguyên tố ở ô số 9: Kí hiệu hóa học F, tên nguyên tố fluorine, số hiệu nguyên tử 9, khối lượng nguyên tử 19 amu.
a) ..?.. chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
b) Nguyên tử của các nguyên tố thuộc cùng chu kì có cùng ..?..
c) Nguyên tử của các nguyên tố cùng nhóm A có ..?.. bằng nhau.
Lời giải:
a) Số hiệu nguyên tử chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
b) Nguyên tử của các nguyên tố thuộc cùng chu kì có cùng số lớp electron.
c) Nguyên tử của các nguyên tố cùng nhóm A có số electron lớp ngoài cùng bằng nhau.
Bài 4.6 trang 15 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Bảng tuần hoàn gồm 3 chu kì nhỏ và 4 chu kì lớn.
B. Số thứ tự của chu kì bằng số electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì đó.
C. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố thuộc chu kì đó.
D. Các nguyên tố trong cùng chu kì được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Lời giải:
Đáp án đúng là: B
Phát biểu B không đúng vì, số thứ tự của chu kì bằng số lớp electron.
Bài 4.7 trang 15 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây là đúng?
A. Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và được xếp vào cùng một hàng.
B. Các nguyên tố thuộc cùng một nhóm có tính chất gần giống nhau.
C. Bảng tuần hoàn gồm 8 nhóm được kí hiệu từ 1 đến 8.
D. Các nguyên tố trong nhóm được xếp thành một cột theo chiều khối lượng nguyên tử tăng dần.
Lời giải:
Đáp án đúng là: B
Các nguyên tố thuộc cùng một nhóm có tính chất gần giống nhau.
A. Sai vì: Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và được xếp vào cùng một cột.
B. Sai vì: Bảng tuần hoàn gồm 8 nhóm A được đánh số từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
D. Sai vì: Các nguyên tố trong nhóm được xếp thành một cột theo chiều điện tích hạt nhân tăng dần.
“Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố kim loại, ..(1).. và khí hiếm. Trong đó nguyên tố .. (2).. chiếm đến 80% tổng số nguyên tố.”
Lời giải:
“Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố kim loại, (1) phi kim và khí hiếm. Trong đó nguyên tố (2) kim loại chiếm đến 80% tổng số nguyên tố.”
Bài 4.9 trang 16 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây là đúng?
A. Các nguyên tố kim loại tập trung hầu hết ở góc trên bên phải của bảng tuần hoàn.
B. Các nguyên tố kim loại tập trung hầu hết ở góc dưới bên trái của bảng tuần hoàn.
C. Các nguyên tố khí hiếm nằm ở giữa bảng tuần hoàn.
D. Các nguyên tố phi kim nằm ở cuối bảng tuần hoàn.
Lời giải:
Đáp án đúng là: B
Các nguyên tố kim loại tập trung hầu hết ở góc dưới bên trái của bảng tuần hoàn.
Các nguyên tố phi kim chủ yếu ở góc trên bên phải của bảng.
Các nguyên tố khí hiếm nằm ở nhóm VIIIA.
Bài 4.10 trang 16 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Các nguyên tố phi kim tập trung ở các nhóm VA, VIA, VIIA.
B. Các nguyên tố khí hiếm nằm ở nhóm VIIIA.
C. Các nguyên tố kim loại có mặt ở tất cả các nhóm trong bảng tuần hoàn.
D. Các nguyên tố lanthanide và actinide, mỗi họ gồm 14 nguyên tố được xếp riêng thành hai dãy cuối bảng.
Trả lời:
Đáp án đúng là: C
Các nguyên tố kim loại gồm:
+ Hầu hết các nguyên tố thuộc nhóm IA, IIA, IIIA và một số nguyên tố nhóm IVA, VA, VIA.
+ Các nguyên tố thuộc nhóm IB đến VIIIB, các nguyên tố lanthanide và các nguyên tố actinide được xếp riêng thành 2 hàng ở cuối bảng.
Bài 4.11 trang 16 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây là đúng?
A. Ở điều kiện thường, tất cả các nguyên tố kim loại tồn tại ở thể rắn.
B. Ở điều kiện thường, tất cả các nguyên tố phi kim tồn tại ở thể lỏng.
C. Ở điều kiện thường, tất cả các khí hiếm tồn tại ở thể khí.
D. Ở điều kiện thường, tất cả các nguyên tố phi kim tồn tại ở thể khí.
Lời giải:
Đáp án đúng là: C
Ở điều kiện thường, tất cả các nguyên tố phi kim tồn tại ở thể khí.
Lời giải:
+ Nguyên tố ở nhóm VA, chu kì 3 là phosphorus (P);
+ Nguyên tố ở nhóm VIIIA, chu kì 2 là neon (Ne).
Lời giải:
Hydrogen kí hiệu hóa học là H, ở chu kì 1, nhóm IA.
Lời giải:
Silicon kí hiệu hóa học là Si, ở chu kì 3, nhóm IVA.
Lời giải:
|
Nhóm |
IA |
IIA |
VIIA |
VIIIA |
|
|
Nguyên tố thuộc chu kì 2 |
Kí hiệu hóa học |
Li |
Be |
F |
Ne |
|
Tên |
Lithium |
Beryllium |
Fluorine |
Neon |
|
Lời giải:
+ Nguyên tố Mg thuộc chu kì 3 nên có 3 lớp electron.
+ Nguyên tố Mg thuộc nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Lời giải:
Nhận định: “Nguyên tử P có 5 lớp electron và 3 electron ở lớp ngoài cùng” là sai vì:
+ Nguyên tố P ở nhóm VA nên có 5 electron ở lớp ngoài cùng.
+ Nguyên tố P ở chu kì 3 nên có 3 lớp electron.
Lời giải:
Nguyên tố X là iodine. Kí hiệu hóa học là I, số hiệu nguyên tử 53, khối lượng nguyên tử 127 amu.
Lời giải:
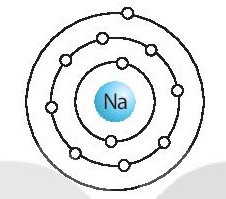
X là sodium hay natri, kí hiệu hóa học là Na.
Na có 3 lớp electron, 1 electron ở lớp ngoài cùng.
Na thuộc chu kì 3, nhóm IA.
Mô hình sắp xếp electron ở vỏ của Na như sau:
Lời giải:
X là calcium (Ca), có mô hình sắp xếp electron ở lớp vỏ nguyên tử:
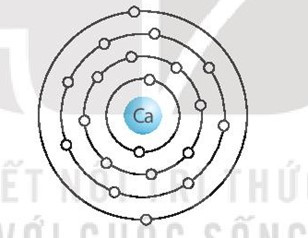
Nguyên tử Ca có 4 lớp electron, 2 electron ở lớp ngoài cùng. Vậy Ca ở chu kì 4, nhóm IIA trong bảng tuần hoàn.
Lời giải:
+ Các nguyên tố: Na, Mg, Ar thuộc cùng một chu kì 3.
+ Các nguyên tố Be, B, C, N, O thuộc cùng một chu kì 2.
Lời giải:
+ Các nguyên tố Na, K thuộc cùng nhóm IA;
+ Các nguyên tố Mg, Ba, Be thuộc cùng nhóm IIA.
Lời giải:
a) Các nguyên tố kim loại: Na, Fe, K, Mg, Ba.
b) Các nguyên tố phi kim: Cl, C, N, S.
c) Các nguyên tố khí hiếm: Kr, Ar.
Bài 4.24 trang 17 SBT Khoa học tự nhiên 7: Hãy tìm hiểu và cho biết:
a) Tên và kí hiệu hóa học của nguyên tố kim loại duy nhất tồn tại ở thể lỏng, ở điều kiện thường. Dựa vào bảng tuần hoàn, hãy cho biết nguyên tố đó ở ô bao nhiêu.
b) Tên và kí hiệu hóa học của nguyên tố kim loại có trong thành phần của hemoglobin (chất có khả năng vận chuyển oxygen từ phổi đến các tế bào), nếu thiếu nguyên tố này cơ thể chúng ta sẽ mắc bệnh thiếu máu. Hãy kể ra ít nhất 3 ứng dụng trong đời sống của nguyên tố kim loại đó.
c) Tên và kí hiệu hóa học của nguyên tố khí hiếm được dùng để bơm vào bóng bay hoặc khinh khí cầu.
Lời giải:
a) Nguyên tố kim loại duy nhất tồn tại ở thể lỏng ở điều kiện thường là Hg, thủy ngân (mercury), ô số 80.
b) Nguyên tố kim loại có trong thành phần của hemoglobin là Fe, sắt (iron).
Một số ứng dụng của Fe trong đời sống:
+ Làm vật liệu xây dựng;
+ Làm đồ dùng cá nhân: dao, kéo …
+ Làm đồ nội thất: khung cửa, cầu thang …
c) Nguyên tố khí hiếm được dùng để bơm vào bóng bay hoặc khinh khí cầu là helium, He.
Lời giải:
Vì có 8 electron ở lớp vỏ nguyên tử nên Xe thuộc nhóm VIIIA – nguyên tố khí hiếm. Xe là chất khí ở điều kiện thường.
Lời giải:
Oxygen là nguyên tố cần thiết cho quá trình hô hấp của sinh vật, nếu thiếu nguyên tố này sự cháy không thể xảy ra.
Oxygen kí hiệu hóa học là O; ô số 8, chu kì 2, nhóm VIA trong bảng tuần hoàn.
Oxygen là phi kim.
Lời giải:
Y có số electron = 2 + 4 = 6 electron.
Vậy số hiệu nguyên tử Y là 6, Y thuộc ô thứ 6 trong bảng tuần hoàn.
Y có 2 lớp electron nên thuộc chu kì 2; lớp ngoài cùng có 4 electron nên thuộc nhóm IVA.
Vì Y thuộc nhóm IVA, chu kì 2 nên Y là phi kim.
Bài 4.28 trang 18 SBT Khoa học tự nhiên 7:
a) Dựa vào bảng tuần hoàn hãy liệt kê kí hiệu hóa học và điện tích hạt nhân Z của các nguyên tố thuộc chu kì 3.
b) Hãy xác định kí hiệu hóa học của nguyên tố X biết nó thuộc chu kì 3, có điện tích hạt nhân Z > 12, dẫn điện tốt, dẫn nhiệt tốt, dẻo, dễ dát mỏng, có ánh kim. Giải thích.
c) Hãy kể ra ít nhất 3 ứng dụng trong đời sống của nguyên tố X.
Lời giải:
a) Các nguyên tố thuộc chu kì 3 và điện tích hạt nhân tương ứng là:
Na (11); Mg (12); Al (13); Si (14); P (15); S (16); Cl (17); Ar (18).
b) X thuộc chu kì 3, có điện tích hạt nhân Z > 12, dẫn điện tốt, dẫn nhiệt tốt, dẻo, dễ dát mỏng, có ánh kim suy ra X là nhôm, Al (aluminium).
c) Nhôm (aluminium) được sử dụng trong công nghiệp như làm vỏ thân máy bay, khung xe máy…; các vật dụng gia đình như nồi, chậu, thìa …; trong xây dựng như khung cửa, …
Xem thêm các bài giải SBT Khoa học tự nhiên 7 Kết nối tri thức hay, chi tiết khác:
Bài 5: Phân tử - đơn chất - hợp chất
Bài 6: Giới thiệu về liên kết hóa học
Bài 7: Hóa trị và công thức hóa học
Lý thuyết KHTN 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
- Năm 1869, Men-đê-lê-ép (D.I.Mendeleev) (1834 -1907), nhà hóa học người Nga đã xây dựng bảng tuần hoàn các nguyên tố hóa học theo chiều tăng dần khối lượng nguyên tử. Sau đó, các nhà khoa học đã chứng minh rằng điện tích hạt nhân nguyên tử mới là cơ sở để xây dựng bảng tuần hoàn các nguyên tố hóa học.
- Ngày nay, bảng tuần hoàn các nguyên tố hóa học gồm 118 nguyên tố hóa học, được xây dựng theo nguyên tắc sau:
+ Các nguyên tố hóa học được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
+ Các nguyên tố trong cũng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất gần giống nhau.
II. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô của bảng tuần hoàn, gọi là ô nguyên tố.
- Ô nguyên tố cho biết:
+ Kí hiệu hóa học.
+ Tên nguyên tố
+ Số hiệu nguyên tử
+ Khối lượng nguyên tử.
- Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số electron trong nguyên tử.
- Số hiệu nguyên tử chính là số thứ tự của nguyên tố trong bảng tuần hoàn.
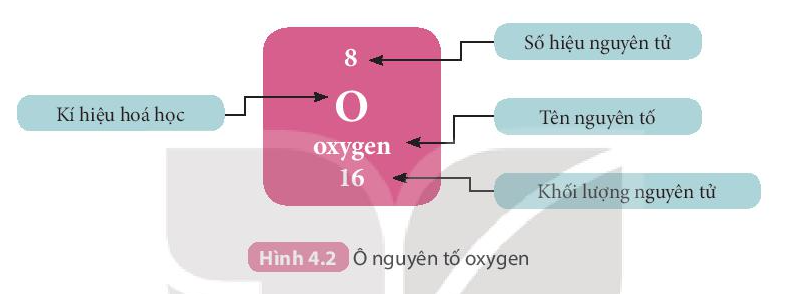
Ví dụ: Các thông tin về nguyên tố ở ô số 8 trong bảng tuần hoàn chi biết:
+ Kí hiệu hóa học: O
+ Tên nguyên tố: Oxygen
+ Số hiệu nguyên tử Z = 8
+ Khối lượng nguyên tử: 16 amu
Ngoài ra: Số hiệu nguyên tử = Số đơn vị điện tích hạt nhân = Số electron = số proton = 8
2. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần khi đi từ trái sang phải.
- Bảng tuần hoàn hiện nay gồm 7 chu kì được đánh số từ 1 đến 7, mỗi chu kì là một hàng ngang (riêng chu kì 6 và chu kì 7, mỗi chu kì có thêm 1 hàng xếp tách riêng ở cuối bảng).
+ Chu kì 1, 2, 3 được gọi là các chu kì nhỏ;
+ Chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
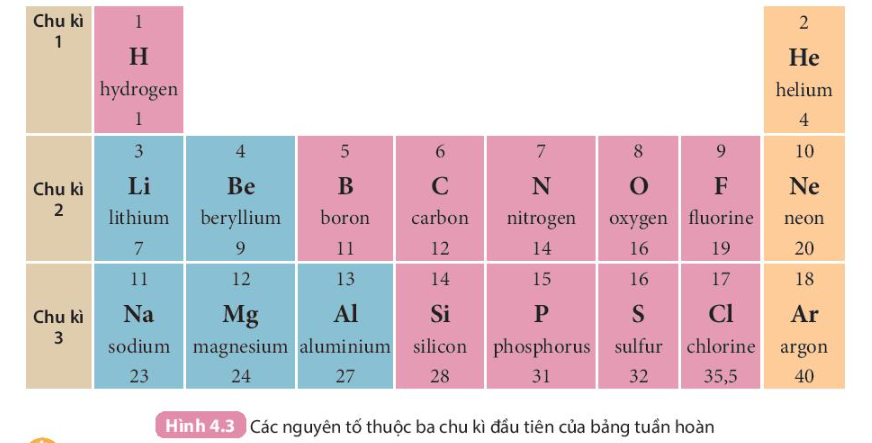
- Trong bảng tuần hoàn, số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
Ví dụ: Các nguyên tố lithium, carbon, oxygen thuộc chu kì 2 đều có 2 lớp electron trong nguyên tử.
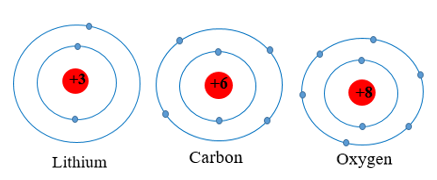
3. Nhóm
- Bảng tuần hoàn gồm có 8 nhóm A được đánh só từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
- Các nguyên tố trong cùng một nhóm A có số electron ở lớp ngoài cùng bằng nhau (trừ trường hợp nguyên tố He), do vậy chúng có tính chất gần giống nhau.
Ví dụ: Nhóm IA gồm 7 nguyên tố từ H đến Fr. Các nguyên tố trong nhóm IA (trừ H) đều có 1 electron lớp ngoài cùng ⇒ Dễ nhường electron ⇒ Tính kim loại mạnh (nhóm các kim loại điển hình).
- Trong một nhóm, khi đi từ trên xuống dưới điện tích hạt nhân nguyên tử của các nguyên tố tăng dần.
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm đó.
Ví dụ:
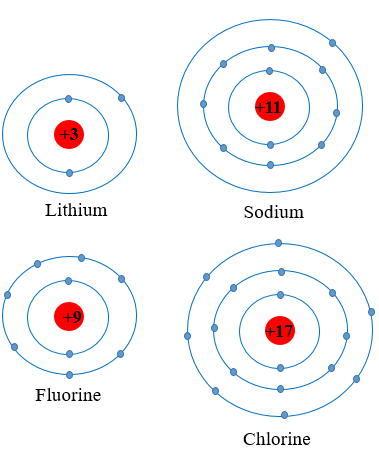
Nguyên tử các nguyên tố Li, Na cùng có 1 electron ở lớp ngoài cùng ⇒ thuộc nhóm IA trong bảng tuần hoàn.
Nguyên tử các nguyên tố F, Cl cùng có 7 electron ở lớp ngoài cùng ⇒ thuộc nhóm VIIA trong bảng tuần hoàn.
Mở rộng:
+ Một số nhóm có tên gọi riêng như: nhóm IA (nhóm kim loại kiềm); nhóm IIA (nhóm kim loại kiềm thổ); nhóm VIIA (nhóm halogen); nhóm VIIIA (nhóm khí hiếm).
+ Nguyên tố H có nhiều tính chất gần giống với nguyên tố nhóm VIIA; nên có thể được xếp ở vị trí đầu nhóm VIIA.
III. Vị trí nhóm các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
1. Các nguyên tố kim loại
- Trong số 118 nguyên tố hóa học đã biết có hơn 90 nguyên tố kim loại.
- Trong bảng tuần hoàn các nguyên tố kim loại ở góc dưới, bên trái của bảng và được thể hiện bằng màu xanh, gồm:
+ Hầu hết các nguyên tố thuộc nhóm IA, IIA, IIIA và một số nguyên tố ở các nhóm IVA, VA, VIA.
+ Các nguyên tố thuộc nhóm IB đến VIIIB, các nguyên tố lathanide và các nguyên tố actinide được xếp riêng thành hai hàng ở cuối bảng.
- Một số nguyên tố kim loại thông dụng và ứng dụng của chúng trong đời sống:
+ Aluminium (Al) được dùng nằm màng bọc thực phẩm vì nhôm dễ dát mỏng, nhẹ, dẫn nhiệt tốt.
+ Copper(Cu) được dùng làm lõi dây điện vì đồng dễ uốn, dẫn điện tốt.
+ Iron (Fe) được dùng trong các công trình xây dựng vì sắt cứng, chịu lực tốt, bền.
+ Gold (Au) được ứng dụng là đồ trang sức vì có tính ánh kim, sáng lấp lánh và dễ dát mỏng.

2. Các nguyên tố phi kim
- Trong 118 nguyên tố hóa học đã biết, có chưa đến 20 nguyên tố là phi kim.
- Ở điều kiện thường các phi kim có thể ở thể rắn, thể lỏng hay thể khí.
Ví dụ:
+ Iodine, sulfur, carbon ở thể rắn
+ Bromine ở thể lỏng
+ Oxygen, nitrogen ở thể khí
- Trong bảng tuần hoàn, các phi kim chủ yếu ở góc bên phải của bảng, được thể hiện bằng màu hồng, gồm:
+ Hầu hết các nguyên tố thuộc nhóm VIIA, VIA, VA.
+ Một số nguyên tố thuộc nhóm IVA, IIIA.
+ Nguyên tố H ở nhóm IA.

- Các nguyên tố phi kim có nhiều ứng dụng như:
+ Oxygen là phi kim không thể thiếu với sự sống của hầu hết các sinh vật, được tạo ra trong quá trình quang hợp và được sử dụng trong quá trình hô hấp.
+ Chlorine có thể được dùng để khử trùng nước sinh hoạt.
3. Các nguyên tố khí hiếm
- Trong số 118 nguyên tố đã biết có 7 nguyên tố là nguyên tố khí hiếm.
- Nguyên tử của chúng có lớp electron ngoài cùng bền vững nên khó bị biến đổi hóa học.
- Trong bảng tuần hoàn, nguyên tố khí hiếm nằm ở nhóm VIIIA và được thể hiện bằng màu vàng.
- Một số ứng dụng trong đời sống của khí hiếm như: He được sử dụng trong khinh khí cầu; Ne được sử dụng trong đèn LED…
Mở rộng:
- Các nguyên tử kim loại có xu hướng nhường electron (để tạo ion dương), còn các phi kim có xu hướng nhận electron (để tạo ion âm) để đạt được lớp electron ngoài cùng bền vững giống khí hiếm là 8 electron hoặc 2 electron (với trường hợp He).