Với giải Câu 3 trang 61 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 12: Liên kết cộng hóa trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Liên kết cộng hóa trị
Câu 3 trang 61 Hóa học 10: Sự hình thành liên kết σ và liên kết π khác nhau như thế nào?
Phương pháp giải:
- Trong các trường hợp xen phủ, các orbital sẽ xen phủ với nhau theo trục liên kết. Sự xen phủ như thế gọi là xen phủ trục, tạo ra liên kết .
- Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên, tạo ra liên kết
Lời giải:
a) Liên kết σ
- Liên kết σ được hình thành do sự xen phủ giữa hai obitan hóa trị của hai nguyên tử tham gia liên kết dọc theo trục liên kết.
- Tính chất của liên kết σ là đối xứng qua trục liên kết, các nguyên tử tham gia liên kết quay quanh trục liên kết. Liên kết σ bền hơn các loại liên kết khác.
b) Liên kết π
- Liên kết π là liên kết được hình thành do sự xen phủ giữa hai obitan hóa trị của 2 nguyên tử tham gia liên kết ở hai bên trục liên kết (xen phủ bên).
- Tính chất của liên kết π là không có tính đối xứng trục, nên hai nguyên tử tham gia liên kết không có khả năng quay quanh trục liên kết và kém bền hơn các liên kết khác.
Lý thuyết Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử
1. Sự xen phủ các orbital nguyên tử tạo liên kết s (sigma)
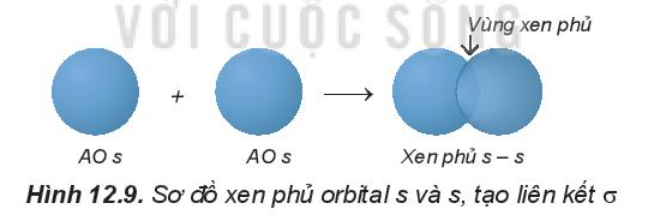
- Sự xen phủ s – s:
Phân tử H2 tạo thành từ hai nguyên tử H (1s1). Khi 2 nguyên tử H tiến lại gần nhau, hạt nhân của nguyên tử này hút đám mây electron của nguyên tử kia, hai orbital nguyên tử xen phủ vào nhau một phần. Vùng xen phủ có mật độ điện tích âm lớn, làm tăng lực hút của mỗi hạt nhân với vùng này và làm cân bằng lực đẩy giữa hai hạt nhân, để hai nguyên tử liên kết với nhau.
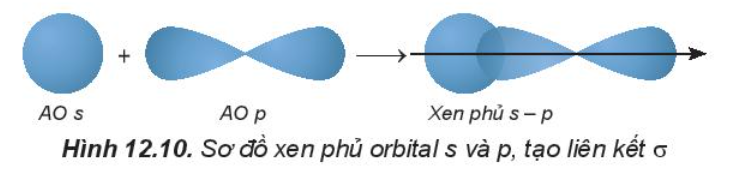
- Sự xen phủ s – p:
Phân tử HF tạo thành khi orbital 1s của nguyên tử H (1s1) xen phủ với orbital 2p của nguyên tử F (2s22p5) theo trục liên kết, tạo liên kết cộng hóa trị giữa H và F, vùng xen phủ càng lớn thì liên kết càng bền.
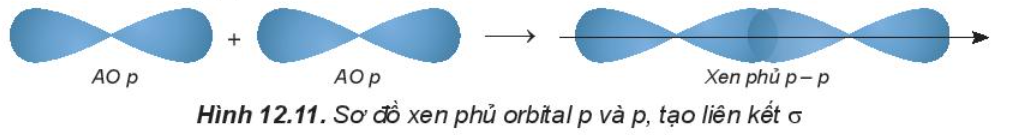
 - Sự xen phủ p – p:
- Sự xen phủ p – p:
Phân tử Cl2 tạo thành khi hai orbital 3p của hai nguyên tử Cl (3s23p5) xen phủ theo trục liên kết của hai nguyên tử Cl.
 Nhận xét:
Nhận xét:
Các liên kết cộng hóa trị đơn đều là liên kết s. Trong liên kết s, mật độ xác suất tìm thấy electron lớn nhất dọc theo trục liên kết.
2. Sự xen phủ các orbital nguyên tử tạo liên kết p (pi)
Sự xen phủ, trong đó trục của các orbital tham gia liên kết song song với nhau và vuông góc với đường nối tâm của hai nguyên tử liên kết, được gọi là xen phủ bên. Sự xen phủ bên tạo ra liên kết p (pi).
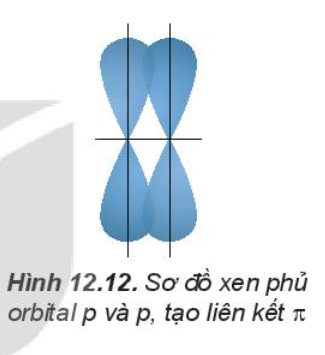 Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
Liên kết đôi gồm một liên kết s và một liên kết p. Liên kết ba gồm một liên kết s và hai liên kết p.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Câu 4 trang 61 Hóa học 10: Số liên kết σ và π có trong phân tử C2H4 lần lượt là...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: