Với giải Câu 1 trang 58 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 12: Liên kết cộng hóa trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 12: Liên kết cộng hóa trị
Câu 1 trang 58 Hóa học 10: Viết công thức electron, công thức cấu tạo và công thức Lewis của các phân tử:
a) Bromine (Br2). b) Hydrogen sulfide (H2S).
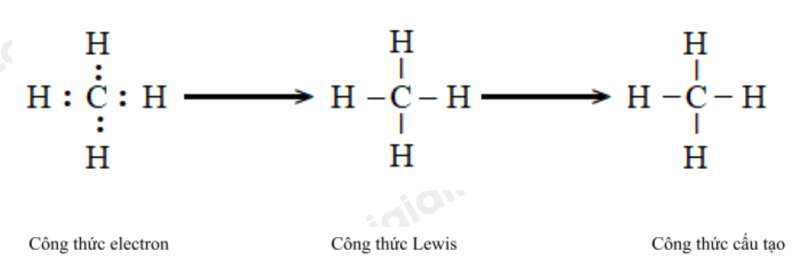
c) Methane (CH4). d) Ammonia (NH3).
e) Ethene ( C2H4). g) Ethyne (C2H2).
Phương pháp giải:
- Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp một hoặc nhiều elctron để tạo thành các cặp electron dùng chung => thu được công thức electron
- Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis (Li – uýt).
- Công thức cấu tạo chỉ còn các liên kết biểu diễn dưới dạng gạch nối, không còn electron.
Lời giải:
a) Bromine (Br2).
Phân tử Bromine: Nguyên tử bromine có 7 electron hóa trị, hai nguyên tử bromine liên kết với nhau bằng cách mỗi nguyên tử bromine đóng góp 1 electron tạo thành cặp electron dùng chung.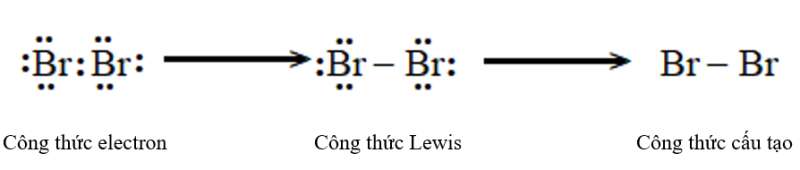
b) Hydrogen sulfide (H2S).
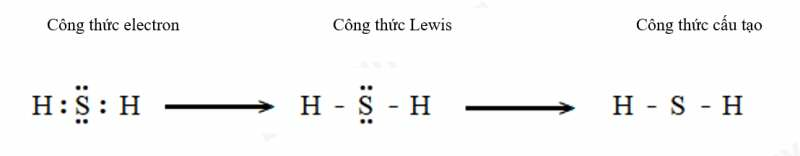
d) Ammonia (NH3)
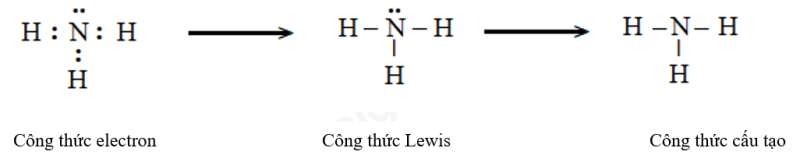
e) Ethene (C2H4)
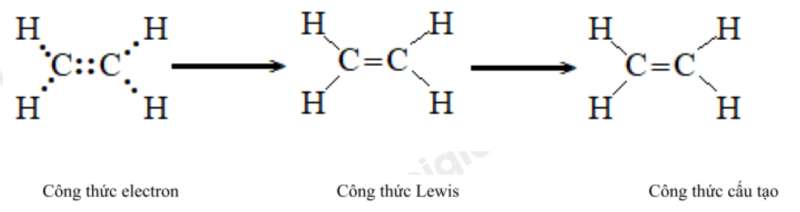
g) Ethyne (C2H2)
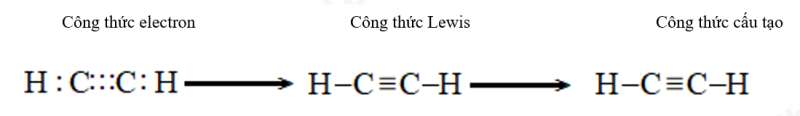
Lý thuyết Sự tạo thành liên kết cộng hóa trị
Nguyên tử phi kim có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm.
Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp chung một hoặc nhiều electron để tạo thành các cặp electron dùng chung. Các cặp electron dùng chung được tính cho cả hai nguyên tử trong phân tử nên mỗi nguyên tử đều đạt cấu hình bền vững theo quy tắc octet. Cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
Cặp electron dùng chung giữa hai nguyên tử có thể được tạo thành theo hai kiểu khác nhau:
- Mỗi nguyên tử góp một hay nhiều electron để tạo thành các cặp electron dùng chung:
Ví dụ:
A× + ×B A : B hoặc A – B (liên kết A – B là liên kết cộng hóa trị).
- Cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa hai nguyên tử là liên kết cộng hóa trị kiểu cho – nhận.
Ví dụ:
Khi cặp electron dùng chung chỉ do nguyên tử B đóng góp, nguyên tử B là nguyên tử cho electron, nguyên tử A là nguyên tử nhận electron. Kí hiệu B A.
1. Sự tạo thành phân tử có liên kết đơn
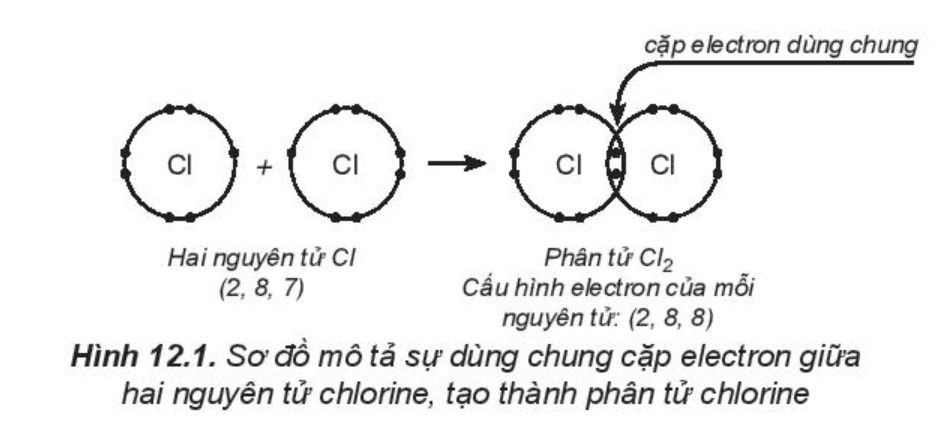
- Phân tử chlorine (Cl2):
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5 (có 7 electron hóa trị).
Hai nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron, tạo thành 1 cặp electron dùng chung. Khi đó, trong phân tử Cl2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet:
Từ công thức electron, thay một cặp electron dùng chung bằng một gạch nối thì thu được công thức Lewis (Li-uýt):
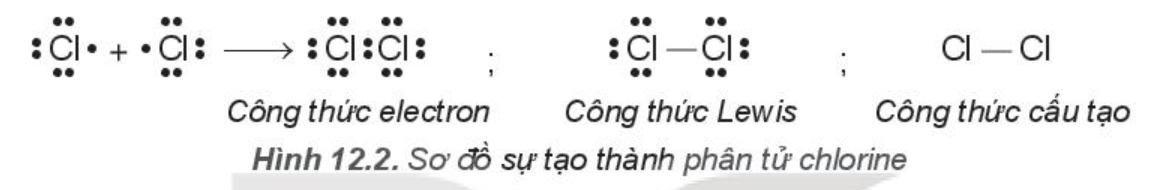
Giữa hai nguyên tử chlorine có một cặp electron dùng chung (biểu diễn bằng một gạch nối), đó là liên kết đơn.
- Phân tử hydrogen chloride (HCl):
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình bền vững của nguyên tử khí hiếm helium) và nguyên tử chlorine có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Giữa hai nguyên tử hydrogen và chlorine có một cặp electron dùng chung (biểu diễn bằng 1 gạch nối), đó là liên kết đơn.
- Phân tử hợp chất có liên kết cho – nhận:
Trong phân tử NH3, lớp ngoài cùng của nguyên tử nitrogen có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không có electron. Khi phân tử NH3 kết hợp với ion H+, nguyên tử nitrogen đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành . Khi đó, liên kết cho – nhận được hình thành, nguyên tử nitrogen là nguyên tử cho, ion H+ là nguyên tử nhận. Trong ion , bốn liên kết N – H hoàn toàn tương đương nhau.
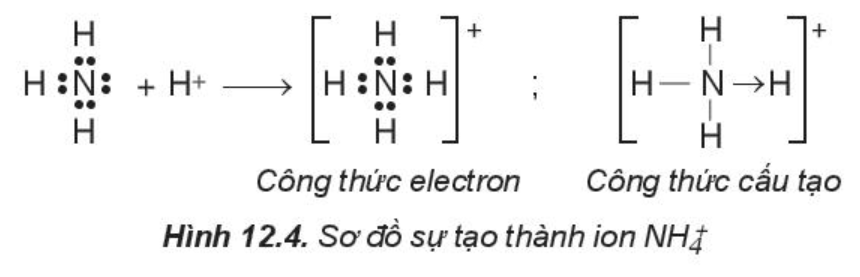 2. Sự tạo thành phân tử có liên kết đôi
2. Sự tạo thành phân tử có liên kết đôi
- Phân tử oxygen (O2):
Mỗi nguyên tử oxygen có 6 electron hóa trị, hai nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành 2 cặp electron dùng chung. Trong phân tử O2, mỗi nguyên tử oxygen đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Giữa hai nguyên tử oxygen có hai cặp electron dùng chung (biểu diễn bằng hai gạch nối), đó là liên kết đôi.
- Phân tử carbon dioxide (CO2):
Nguyên tử carbon có 4 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị. Hai nguyên tử oxygen liên kết với một nguyên tử carbon bằng cách mỗi nguyên tử oxygen đóng góp 2 electron và nguyên tử carbon đóng góp 4 electron tạo thành 4 cặp electron dùng chung. Khi đó, trong phân tử CO2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.
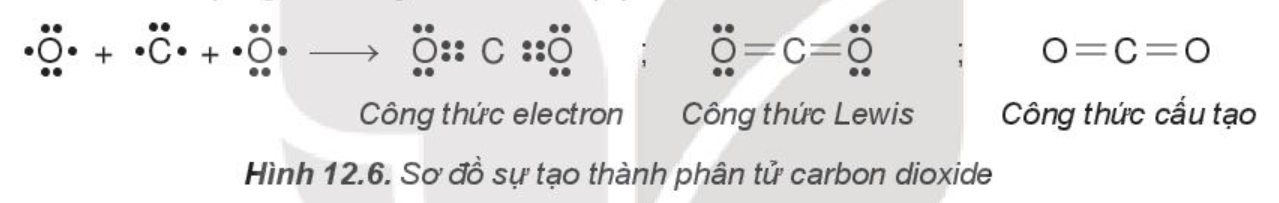 Phân tử CO2 có hai liên kết đôi.
Phân tử CO2 có hai liên kết đôi.
3. Sự tạo thành phân tử có liên kết ba
Phân tử nitrogen (N2):
Nguyên tử nitrogen có 5 electron hóa trị, hai nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung. Khi đó, trong phân tử N2, mỗi nguyên tử đều có 8 electron ở lớp ngoài cùng, thỏa mãn quy tắc octet.

Giữa hai nguyên tử nitrogen có ba cặp electron dùng chung (biểu diễn bằng ba gạch nối), đó là liên kết ba.
Kết luận:
- Liên kết cộng hóa trị là liên kết được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
- Liên kết trong các phân tử Cl2, O2, N2, … có cặp electron dùng chung không bị hút lệch về phía nguyên tử nào được gọi là liên kết cộng hóa trị không phân cực.
- Liên kết trong phân tử HCl có cặp electron dùng chung lệch về phía nguyên tử có độ âm điện lớn hơn (Cl) được gọi là liên kết cộng hóa trị phân cực.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Câu 3 trang 61 Hóa học 10: Sự hình thành liên kết σ và liên kết π khác nhau như thế nào?...
Câu 4 trang 61 Hóa học 10: Số liên kết σ và π có trong phân tử C2H4 lần lượt là...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: