Với Giải hóa học lớp 10 trang 50 Kết nối tri thức chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải hóa học 10 trang 50 Kết nối tri thức
Câu 3 trang 50 Hóa học 10: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: F2, CCl4 và NF3.
Phương pháp giải:
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm ( trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
- Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử F2 được biểu diễn
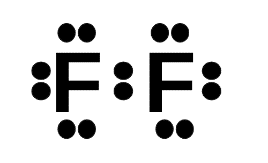
Xung quanh mỗi nguyên tử fluorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử CCl4, nguyên tử carbon có 4 electron hóa trị, nguyên tử carbon cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung một 1 electron. Phân tử CCl4 được biểu diễn

Xung quanh mỗi nguyên tử carbon và chlorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử NF3, nguyên tử nitrogen có 5 electron hóa trị, nguyên tử nitrogen cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử NF3 được biểu diễn
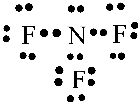
Xung quanh mỗi nguyên tử nitrogen và florine đều có 8 electron
Câu 4 trang 50 Hóa học 10: Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu, có mùi tỏi, không bền, tự cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng. Phosphine sinh ra khi phân hủy xác động, thực vật và thường xuyên xuất hiện trong thời tiết mưa phùn (hiện tương “ma trơi”).
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Phương pháp giải:
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm ( trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Lời giải:
- Khi hình thành liên kết hóa học trong phân tử PH3, nguyên tử phosphorus có 5 electron hóa trị, nguyên tử phosphorus cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử hydrogen góp chung một 1 electron. Phân tử PH3 được biểu diễn
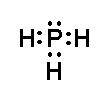
Xung quanh mỗi nguyên tử phosphorus đều có 8 electron.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác: