Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 11 Bài 40: Ancol chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 40: Ancol
Bài 40.1 trang 62 SBT Hóa học 11: Trong các chất dưới đây, chất nào là ancol ?
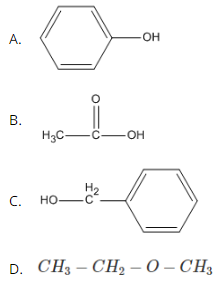
Lời giảit:
Trong các chất trên ancol là:
Chọn C.
Bài 40.2 trang 62 SBT Hóa học 11: Chất
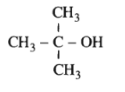 có tên là:
có tên là:
A. 1,1-đimetyletanol
B. 1,1-đimetyletan-1-ol
C. isobutan-2-ol
D. 2-metylpropan-2-ol
Lời giải:
Chất trên có tên là: 2-metylpropan-2-ol
Chọn D.
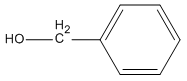
Bài 40.3 trang 62 SBT Hóa học 11: Ancol isobutylic có công thức cấu tạo như thế nào ?
Lời giải:
Ancol isobutylic là: 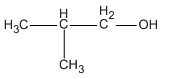
Chọn B.
Bài 40.4 trang 62 SBT Hóa học 11: Trong số các ancol sau đây :
A. CH3-CH2-CH2-OH
B. CH3-CH2-CH2-CH2-OH
C. CH3-CH2-CH2-CH2-CH2-OH
D. CH3-CH2-CH2-CH2-CH2-CH2-OH
1. Chất nào có nhiệt độ sôi cao nhất ?
2. Chất nào có khối lượng riêng cao nhất ?
3. Chất nào dễ tan nhất trong nước ?
Lời giải:
1. Chất có nhiệt độ sôi cao nhất là: CH3-CH2-CH2-CH2-CH2-CH2-OH Chọn D.
2. Chất có khối lượng riêng cao nhất là: CH3-CH2-CH2-CH2-CH2-CH2-OH Chọn D.
3. Chất dễ tan nhất trong nước là: CH3-CH2-CH2-OH Chọn A.
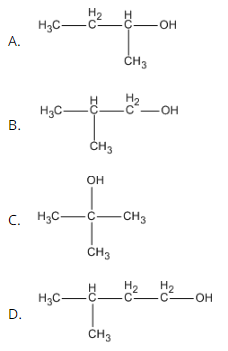
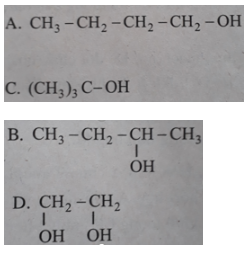
Bài 40.5 trang 62 SBT Hóa học 11: Trong các chất dưới đây, chất nào là ancol bậc III?

Lời giải:
Bậc của ancol = bậc của nguyên tử C liên kết với nhóm -OH.
Chọn D.
Bài 40.6 trang 62 SBT Hóa học 11: Trong các ancol dưới đây, chất nào không bị oxi hóa bởi CuO (mà không bị gãy mạch cacbon)?
Lời giải:
Khi oxi hóa nhẹ thì ancol bậc 1 tạo anđehit; ancol bậc 2 tạo xeton; ancol bậc 3 không phản ứng.
Chọn C.
Bài 40.7 trang 62 SBT Hóa học 11: Trong số các phản ứng hoá học dưới đây, phản ứng nào là phản ứng oxi hoá - khử ?
A. 2C3H5(OH)3 + Cu(OH)2 [C3H5(OH)2O]2Cu + 2H2O
B. C2H5OH + HBr C2H5-Br + H2 O
C. C2H5OH + 2Na 2C2H5ONa + H2
D. 2C2H5OH (C2H5)2O + H2O.
Phương pháp giải:
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Lời giải:
Trong các phản ứng trên, phản ứng có sự thay đổi số oxi hóa Đây là phản ứng oxi hóa – khử
Chọn C.
Bài 40.8 trang 63 SBT Hóa học 11:
Viết phương trình hoá học của phản ứng thực hiện các biến hoá dưới đây, ghi rõ điều kiện của từng phản ứng.
Tinh bột Glucozơ Ancol etylic Anđehit axetic
Lời giải:
Bài 40.9 trang 63 SBT Hóa học 11: Từ ancol propylic và các chất vô cơ, có thể điều chế propen, propyl bromua, đipropyl ete. Viết phương trình hoá học của các phản ứng thực hiện các chuyển hoá đó.
Lời giải:
Bài 40.10 trang 63 SBT Hóa học 11:
Chất A là một ancol no mạch hở. Để đốt cháy hoàn toàn 0,35 mol A phải dùng vừa hết 31,36 lít O2 (đktc). Hãy xác định công thức phân tử, công thức cấu tạo và tên của A
Phương pháp giải:
) Gọi CTPT của A: CnH2n+2Ox
+) PTHH:
+) Tính theo PTTH, lập phương trình biểu diễn x theo n.
+) Biện luận n x CTPT của A.
+) Viết CTCT của A.
Lời giải:
Ancol no mạch hở là ; CTPT là CnH2n+2Ox.
Theo phương trình : 1 mol ancol tác dụng với mol
0,35 mol ancol tác dụng với = 1,4 mol O2
= = 4 3n + 1 - x = 8 x = 3n - 7
Ở các ancol đa chức, mỗi nguyên tử cacbon không thể kết hợp với quá 1 nhóm OH ; vì vậy 1 x n.
1 3n - 7 n
2,67 n 3,5 ; n nguyên n = 3
x = 3.3 - 7 = 2.
Công thức phân tử : C3H802.
Các công thức cấu tạo :
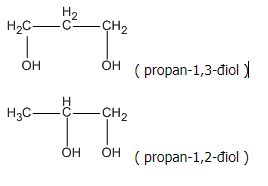
Bài 40.11 trang 64 SBT Hóa học 11: Chất X là một ancol không no đơn chức, phân tử có 1 liên kết đôi. Để đốt cháy hoàn toàn 1,45 g X cần dùng vừa hết 2,24 lít (đktc).
Xác định công thức phân tử, viết công thức cấu tạo và tên chất X.
Phương pháp giải:
+) Gọi chất X có dạng CnH2n-1OH, CTPT là CnH2nO
+) Viết PTHH:
+) Tính theo PTHH n CTPT
+) Viết CTCT.
Lời giải:
Chất X có dạng CnH2n-1OH, CTPT là CnH2nO
Theo phưomg trình : Cứ (14n + 16) g X tác dụng với mol
Theo đầu bài: Cứ 1,45 g X tác dụng với = 0,1 (mol) .
CTPT : C3H60.
CTCT : CH2 = CH - CH2 - OH ( propenol )
Bài 40.12 trang 64 SBT Hóa học 11: Hỗn hợp M chứa hai ancol no, đơn chức, mạch hở kế tiếp nhau trong dãy đồng đẳng. Để đốt cháy hoàn toàn 35,6 g hỗn hợp M cần dùng vừa hết 63,84 lít O2 (đktc).
Hãy xác định công thức phân tử và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải:
Cách 1.
+) Giả sử trong 35,6 g hỗn hợp M có x mol CnH2n+1OH và y mol Cn+1H2n+3OH
+) Viết PTHH:
+) Dựa vào dữ kiện đề bài lập hệ phương trình ẩn n, x, y.
+) Giải và biện luận phương trình x, y, n CTPT và phần trăm về khối lượng của từng chất trong hỗn hợp M
Cách 2.
Gợi ý: Sử dụng phương pháp trung bình
Lời giải:
Cách 1.
Giả sử trong 35,6 g hỗn hợp M có x mol CnH2n+1OH và y mol Cn+1H2n+3OH :
(14n + 18)x + (14n + 32)y = 35,6 (1)
x mol x mol
y mol y mol
Số mol O2:
Nhân (2) với 14 : 14nx + (14n + 14)y = 26,6 (2')
Lấy (1) - (2') ta được 18x + 18y = 9
x + y = 0,5
Từ (2) : n (x + y) + y = 1,9 y = 1,9 - 0,5n
0 < y < 0,5 0 < 1,9 - 0,5n < 0,5 2,8 < n < 3,8
n = 3 y = 1,9 - 1,5 = 0,4 x = 0,5 - 0,4 = 0,1.
%m (C3H7OH hay C3HsO): . 100%= 16,85%.
%m (C4H9OH hay C4H10O): 100% - 16,85% = 83,15%.
Cách 2.
Đặt công thức của 2 ancol là
Theo phương trình : (14 + 18) g ancol tác dụng với mol O2
Theo đầu bài : 35,6 g ancol tác dụng với 2,850 mol O2
Hai ancol là (x mol) và (y mol)
Từ đó tính được phần trăm khối lượng từng chất (như ở trên).
Bài 40.13 trang 64 SBT Hóa học 11: Hỗn hợp A chứa 2 ancol no, đơn chức, mạch hở. Để đốt cháy hoàn toàn hỗn hợp A cần dùng vừa hết 3,36 lít O2 (đktc). Trong sản phẩm cháy, khối lượng CO2 nhiều hơn khối lượng H2O là 1,88 g.
1. Xác định khối lượng hỗn hợp A.
2. Xác định công thức phân tử và phần trăm khối lượng của từng chất trong A nếu biết thêm rằng hai ancol đó khác nhau 2 nguyên tử cacbon.
Phương pháp giải:
Cách 1.
+) Hỗn hợp A gồm x mol CnH2n+1OH và y mol CmH2m+1OH
+) Dựa vào dữ kiện đề bài lập hệ phương trình ẩn n, m, x, y.
+) Giải và biện luận tìm n, m, x, y công thức phân tử và phần trăm khối lượng của từng chất trong A.
Cách 2.
Gợi ý: Sử dụng phương pháp trung bình.
Lời giải:
Cách 1.
1. Hỗn hợp A gồm x mol CnH2n+1OH và y mol CmH2m+1OH.
Khối lượng hỗn hợp A là :
(14n + 18)x + (14m + 18)y = 14 (nx + my) + 18(x + y)
x mol x mol nx mol (n + 1)x mol
y mol y mol my mol (m + 1)y mol
Số mol O2 :
Hiệu khối lượng của CO2 và của H2O :
44(nx + my) - 18[(n + 1)x + (m + 1)y] = 1,88
26(nx + my) - 18(x + y) = 1,88 (2)
Từ (1) và (2), tìm được : x + y = 0,04.
Khối lượng hỗn hợp A là : 14.0,1 + 18.0,04 = 2,12 (g).
2. Vì m = n + 2 ; ta có : nx + (n + 2)y = 0,1
n(x + y) + 2y = 0,1 y = 0,05 - 0,02n
0 < y < 0,04 0,5 < n < 2,5
Nếu n = 1, hai ancol là CH3OH và
y = 0,03 và x = 0,01
CH3OH chiếm 15,1% ; C3H7OH chiếm 84,9% khối lượng hỗn hợp A.
Nếu n = 2, hai ancol là C2H5OH và
y = 0,01 và x = 0,03
C2H5OH chiếm 65,1%, chiếm 84,9% khối lượng hỗn hợp A.
Cách 2.
1. Công thức chung của hai ancol là và tổng số mol của chúng là a. Khối lượng hỗn hợp : (14 + 18)a.
a mol a mol a mol a mol
Khối lượng hỗn hợp : (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.
Bài 40.14 trang 64 SBT Hóa học 11: Hỗn hợp A chứa glixerol và một ancol đơn chức. Cho 20,3 g A tác dụng với natri (lấy dư) thu được 5,04 lít H2 (đktc). Mặt khác 8,12 g A hoà tan vừa hết 1,96 g Cu(OH)2.
Xác định công thức phân tử, các công thức cấu tạo có thể có, tên và phần trăm về khối lượng của ancol đơn chức trong hỗn hợp A.
Phương pháp giải:
+) PTHH: 2C3H5(OH)3 + Cu(OH)2 [C3H5(OH)2O]2 Cu + 2H2O
+) Tính theo PTHH => số mol glixerol trong 8,12 g A=> Số mol glixerol trong 20,3 g A
+) Tính khối lượng R-OH trong 20,3g A.
+) Pt phản ứng với Na:
2C3H5(OH)3 + 6Na 2C3H5(ONa)3 + 3H2
2R-OH + 2Na 2R-ONa + H2
+) Tính theo PTHH => khối lượng mol của R-OH => R => CTPT
+) Viết các CTCT và gọi tên
Lời giải:
Khi 8,12 g A tác dụng với Cu(OH)2 chỉ có 1 phản ứng hoá học :
2C3H5(OH)3 + Cu(OH)2 [C3H5(OH)2O]2 Cu + 2H2O
đồng(II) glixerat
Số mol glixerol trong 8,12 g A = 2.số mol Cu(OH)2
= 2. =0,04 (mol).
Số mol glixerol trong 20,3 g A là : .
Khối lượng glixerol trong 20,3 g A là : 0,1.92 = 9,2 (g).
Khối lượng R-OH trong 20,3 g A là : 20,3 - 9,2 = 11,1 (g).
Khi 20,3 g A tác dụng với Na có 2 phản ứng hoá học
2C3H5(OH)3 + 6Na 2C3H5(ONa)3 + 3H2
0,1 mol 0,15mol
2R-OH + 2Na 2R-ONa + H2
x mol 0,5x mol
Số mol H2 = .
Khối lượng 1 mol R-OH : .
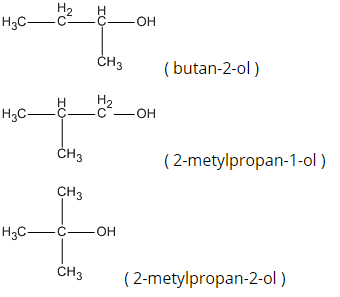
R-OH = 74 R = 74 - 17 = 57 ; R là
CTPT :
Các CTCT và tên : ( butan-1-ol )
Bài 40.15 trang 64 SBT Hóa học 11: Đun một hỗn hợp 2 ancol no, đơn chức, mạch hở với H2SO4 ở 140°C, thu được 72 g hỗn hợp 3 ete với số mol bằng nhau. Khối lượng nước tách ra trong quá trình tạo thành các ete đó là 21,6 g.
Xác định công thức cấu tạo của 2 ancol và khối lượng mỗi ancol phản ứng.
Phương pháp giải:
+) Viết các PTHH:
+) Số mol 3 ete = số mol H2O=> Số mol mỗi ete.
+) Dựa vào dữ kiện "thu được 72 g hỗn hợp 3 ete với số mol bằng nhau" => pt toán học ẩn m, n.
+) Biện luận n, m => CTPT => Khối lượng của mỗi ancol
Lời giải:
Số mol 3 ete = số mol H2O = = 1,2 (mol).
Số mol mỗi ete = = 0,4 (mol).
Khối lượng 3 ete :
(28n + 18).0,4 + (28m + 18).0,4 + (14n + 14m + 18).0,4 = 72.0 n + m = 3.
Vì n và m đều nguyên và dương nên chỉ có thể n = 1 và m = 2 (hoặc ngược lại).
Hai ancol là CH3-OH và CH3-CH2-OH.
Số mol mỗi ancol là 1,2 mol.
Khối lượng CH3-OH là : 1,2.32 = 38,4 (g).
Khối lượng C2H5OH là : 1,2.46 = 55,2 (g).
Bài 40.16* trang 64 SBT Hóa học 11: Hỗn hợp khí A chứa 2 anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với khí nitơ là 1,35.
1. Xác định công thức phân tử 2 anken.
2. Nếu hiđrat hoá một lượng hỗn hợp A (giả sử hiệu suất là 100%) thì được hỗn hợp ancol B, trong đó tỉ lệ về khối lượng giữa ancol bậc một và ancol bậc hai là 43 : 50.
Hãy cho biết tên và phần trăm về khối lượng của từng ancol trong hỗn hợp B.
Phương pháp giải:
1. Dựa vào tỉ khối hơi của A => Biểu diễn khối lượng mol 2 anken theo ẩn n ( CnH2n < 37,8 < Cn+1H2n+2) => n => CTPT 2 anken.
2. +) Giả sử trong 1 mol hỗn hợp A có x mol C3H6 và (1 - x) mol C2H4
+) Dựa vào dữ kiện "Tỉ khối của A đối với khí nitơ là 1,35" => x
+) Khi hiđrat hóa hoàn toàn 1 mol A:
CH2 = CH2 + H2O CH3 - CH2 - OH
0,3 mol 0,3 mol
CH3 - CH = CH2 + H2O CH3 - CH2 - CH2 - OH
a mol
CH3 - CH = CH2 + H2O 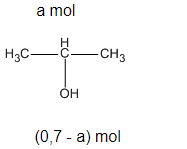
(0,7 - a) mol
+) Dựa vào dữ kiện "tỉ lệ về khối lượng giữa ancol bậc một và ancol bậc hai là 43 : 50" => a
+) Hỗn hợp B gồm CH3 - CH2 - OH ; CH3 - CH2 - CH2 - OH và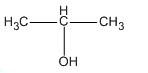
+) Tìm số mol từng chất trong B => phần trăm về khối lượng của chúng.
Lời giải:
1. Hỗn hợp khí A chứa CnH2n và Cn+1H2n+2 với phân tử khối trung bình là : 1,35.28 = 37,8
CnH2n < 37,8 < Cn+1H2n+2
14n < 37,8 < 14n + 14
1,70 < n < 2,70 n = 2.
CTPT của 2 anken là C2H4 và C3H6.
2. Giả sử trong 1 mol hỗn hợp A có x mol C3H6 và (1 - x) mol C2H4 :
42x + 28(1 - x) = 37,8 x = 0,7
Như vậy, trong 1 mol hỗn hợp A có 0,7 mol C3H6 và 0,3 mol C2H4.
Giả sử hiđrat hoá hoàn toàn 1 mol A :
CH2 = CH2 + H2O CH3 - CH2 - OH
0,3 mol 0,3 mol
CH3 - CH = CH2 + H2O CH3 - CH2 - CH2 - OH
a mol
CH3 - CH = CH2 + H2O
(0,7 - a) mol Tỉ lệ khối lượng giữa ancol bậc I so với ancol bậc II :
Hỗn hợp B gồm 0,3 mol CH3 - CH2 - OH ; 0,2 mol CH3 - CH2 - CH2 - OH và 0,5 mol 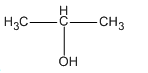 ; có khối lượng tổng cộng là 55,8 g.
; có khối lượng tổng cộng là 55,8 g.
% về khối lượng etanol (ancol etylic) là :
% về khối lượng của propan-1-ol (ancol propylic) là :
Propan-2-ol (ancol isopropylic) chiếm :
Riêng câu 2 cũng có thể lập luận như sau :
Phần trăm khối lượng của ancol bậc II (ancol isopropylic) :
Vậy phần trăm khối lượng của 2 ancol bậc I là 46,2%.
Nếu dùng 1 mol A (37,8 g) thì lượng H2O là 1 mol (18 g) và khối lượng hỗn hợp B là 37,8 + 18, = 55,8 (g), trong đó 0,3 mol C2H4 tạo ra 0,3 mol ancol etylic.
Phần trăm khối lượng của ancol etylic là và của ancol propylic là 46,2% - 24,7% = 21,5%.