Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 11 Bài 44: Anđehit - Xeton chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Anđehit - Xeton lớp 11.
Giải bài tập Hóa học lớp 11 Bài 2: Anđehit - Xeton
Câu hỏi và bài tập ( trang 203, 204 SGK Hóa học 11)
Bài 1 trang 203 SGK Hóa học 11: Thế nào là anđehit? Viết công thức cấu tạo của các anđehit có công thức phân tử C4H8O và gọi tên chúng.
Lời giải :
- Định nghĩa: anđehit là những hợp chất hữu cơ mà phân tử có nhóm -CH=O liên kết trực tiếp với nguyên tử cacbon (1) hoặc nguyên tử hiđro
(1) Nguyên tử cacbon này có thể của gốc hiđrocacbon hoặc nhóm -CHO
- Các CTCT của anđehit có CTPT C4H8O:
CH3-CH2-CH2-CHO anđehit butyric (butanal).
CH3- CH (CH3)–CHO anđehit isobutiric (2- metyl propanal).
Bài 2 trang 203 SGK Hóa học 11: Viết các phương trình hóa học để chứng tỏ rằng, anđehit vừa có tính oxi hóa vừa có tính khử.
Lời giải :
CH3CH=O + H2 CH3CH2OH
Chất oxi hóa Chất khử
CH3-CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag + 2NH4NO3
Chất khử Chất OXH
Bài 3 trang 203 SGK Hóa học 11: Hoàn thành dãy chuyển hóa sau bằng các phương trình hóa hoc:
Metan → metyl clorua → methanol→ metanal → axit fomic
Lời giải :
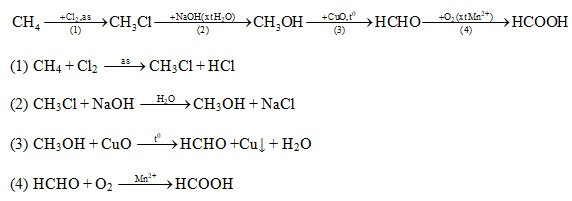
Bài 4 trang 203 SGK Hóa học 11: Cho 1,0 ml dung dịch fomanđehit 5 % và 1,0 ml dung dịch NaOH 10,0 % vào ống nghiệm, sau đó thêm tiếp từng giọt dung dịch CuSO4và lắc đều cho đến khi xuất hiện kết tuả. Đun nóng phần dung dịch phía trên, thấy có kết tủa màu đỏ gạch của Cu2O. Giải thích hiện tượng thí nghiệm và viết phương trình hóa học.
Lời giải :
- Khi nhỏ dung dịch CuSO4 vào thì có kết tủa xanh xuất hiện:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
- Khi đun nóng phần trên ống nghiệm trên ngọn lửa đèn cồn thì có kết tủa đỏ gạch xuất hiện:
HCHO + 4Cu(OH)2 + 2NaOH → Na2CO3 + 2 Cu2O↓đỏ gạch + 6H2O
Bài 5 trang 203 SGK Hóa học 11: Cho 50,0 gam dung dịch anđehit axetic tác dụng với dung dịch AgNO3 trong NH3 (đủ) thu được 21,6 gam Ag kết tủa. Tính nồng độ % của anđehit axetic trong dung dịch đã dùng.
Phương pháp giải:
Viết PTHH xảy ra:
CH3CH=O + 2AgNO3 + 3NH3 → CH3COONH4 + 2Ag↓ + 2NH4NO3
nCH3CHO = ½ nAg = ? (mol)
=> C% CH3CHO =
Lời giải :
CH3CH=O + 2AgNO3 + 3NH3 → CH3COONH4 + 2Ag↓ + 2NH4NO3
nCH3CHO = ½ nAg = 0,1 (mol)
Bài 6 trang 203 SGK Hóa học 11: Ghi Đ(đúng) hoặc S (sai) vào ô trống bên cạnh các câu sau:
a) Anđehit là hợp chất chỉ có tính khử.
b) Anđehit cộng hiđro tạo thành ancol bậc một.
c) Anđehit tác dụng với dung dịch bạc nitrat trong amoniac sinh ra bạc kim loại.
d) Anđehit no, đơn chức, mạch hở có công thức phân tử tổng quát CnH2nO.
e) Khi tác dụng với hiđro, xeton bị khử thành ancol bậc II.
Lời giải:
a. S vì anđehit có cả tính khử và tính oxi hóa
b. Đ vì
c. Đ vì
d. Đ vì CTTQ của anđehit no, đơn chức, mạch hở là CnH2nO
e. Đ vì
Bài 7 trang 203 SGK Hóa học 11: Cho 8,0 gam hỗn hợp hai anđehit kế tiếp nhau trong dãy đồng đẳng của anđehit no, đơn chức, mạch hở tác dụng với bạc nitrat trong dung dịch ammoniac (lấy dư) thu được 32,4 gam bạc kết tủa. Xác định công thức phân tử, viết công thức cấu tạo và gọi tên các anđehit.
Lời giải :
Trường hợp 1: Hai anđehit là HCHO (a mol) và CH3CHO (b mol)
Ta có:
a 4a
b 2b
Theo bài ra ta có hệ phương trình:
Trường hợp 2: Hỗn hợp hai anđehit không chứa HCHO
Gọi công thức chung của anđehit là
Theo phương trình:
Vậy hai anđehit là CH3CHO (etanal) và C2H5CHO (propanal)
Bài 8 trang 204 SGK Hóa học 11: Oxi hóa không hoàn toàn etilen (có xúc tác) để điều chế anđehit axetic thu được hỗn hợp X. Dẫn 2,24 lít khí X (quy về đktc) vào một lượng dư dung dịch bạc nitrat trong NH3 đến khi phản ứng hoàn toàn thấy có 16,2 gam bạc kết tủa.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính hiệu suất của quá trình oxi hóa etilen.
Phương pháp giải :
Tính toán theo PTHH
Phương trình phản ứng:
2CH2=CH2 + O2 → 2CH3CHO (1)
Hỗn hợp X gồm: CH2=CH2 và CH3CHO
CH3CHO + 2AgNO3 + 3NH3 → CH3COONH4 + 2Ag↓ + 2NH4NO3 (2)
Từ mol Ag => số mol của CH3CHO => nC2H4 pư = nCH3CHO = ? (mol)
2,24 lít X => số mol của CH2=CH2dư
nC2H4 ban đầu = nCH3CHO + nC2H4 dư
Lời giải :
Phương trình phản ứng:
2CH2=CH2 + O2 → 2CH3CHO (1)
Hỗn hợp X gồm: CH2=CH2 và CH3CHO
CH3CHO + 2AgNO3 + 3NH3 → CH3COONH4 + 2Ag↓ + 2NH4NO3 (2)
Theo phương trình (2):
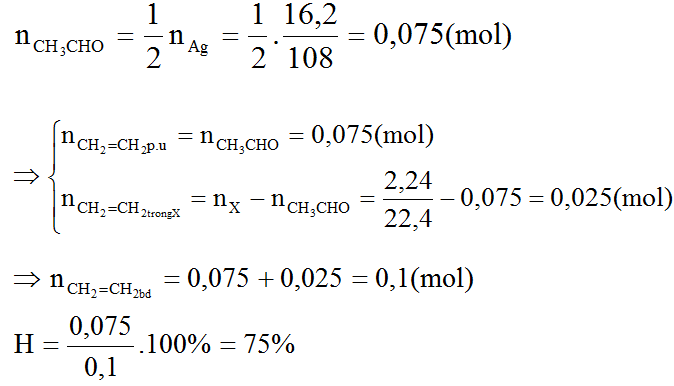
Bài 9 trang 204 SGK Hóa học 11: Hợp chất X no, mạch hở có phần trăm khối lượng C và H lần lượt bằng 66,67% và 11,11% còn lại là O. tỉ số hơi của X so với oxi bằng 2,25
a) Tìm công thức phân tử của X
b) X không tác dụng với dung dịch AgNO3 trong NH3 nhưng khi tác dụng với hiđro sinh ra X1. X1 tác dụng được với natri giải phóng hiđro. Viết công thức cấu tạo và gọi tên của hợp chất X.
Phương pháp giải:
a) Ta có MX = 2,25.32 = 72 (g/mol)
%O = 100% - %C - %H = 100% - 66,67% - 11,11% = 22,22%
Gọi công thức phân tử của X là CxHyOz
=> Công thức đơn giản nhất của X
Có phân tử khối của X, CTĐGN => CTPT của X
b) X là xeton
Lời giải :
Ta có MX = 2,25.32 = 72 (g/mol)
%O = 100% - %C - %H = 100% - 66,67% - 11,11% = 22,22%
Gọi công thức phân tử của X là CxHyOz
=> Công thức đơn giản nhất của X là: C4H8O
CTPT của X là (C4H8O)n
Ta có : MX = 72 (g/mol) => (4.12 + 8 +16 )n = 72 => 72n = 72 => n = 1
Vậy CTPT của X là C4H8O2
b) X không tác dụng được với dung dịch AgNO3 trong NH3, khi tác dụng với hiđro sinh ra , tác dụng natri giải phóng hiđro => X là xeton
CTCT và tên gọi của X là:
![]()