Với giải Câu hỏi 5 trang 86 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 17: Biến thiên enthalpy trong các phản ứng hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Câu hỏi 5 trang 86 Hóa học 10: Cho phản ứng:
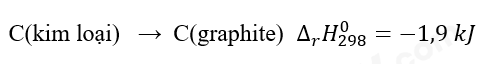
a) Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
b) Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2(g) → CO2(g), carbon ở dạng kim cương hay graphite?
Phương pháp giải:
a) Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt.
∆rH > 0: phản ứng thu nhiệt
∆rH < 0: phản ứng tỏa nhiệt
b) Nhiệt tạo thành càng nhỏ( năng lượng thấp) => Chất càng dễ phản ứng
Lời giải:
a. Biến thiên enthalpy của phản ứng = -1,9 kJ < 0
=> Phản ứng tỏa nhiệt => Graphite có nhiệt tạo thành nhỏ hơn kim cương nên graphite có mức năng lượng thấp thơn.
b. Ở điều kiện chuẩn, graphite có mức năng lượng thấp nên dễ bị phá vỡ cấu trúc
=> Graphite phản ứng được với nhiều chất khác
=> Trong phản ứng trên, carbon ở dạng kim cương.
Lý thuyết Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
1. Khái niệm nhiệt tạo thành
Nhiệt tạo thành (DfH) của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
Nhiệt tạo thành chuẩn () là nhiệt tạo thành ở điều kiện chuẩn.
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0. Ví dụ: kJ.
Ví dụ 1: Nước lỏng được tạo thành từ khí hydrogen và khí oxygen theo phản ứng:
H2(g) + O2(g) H2O(l)
Ở điều kiện chuẩn, cứ 1 mol H2O(l) tạo thành từ 1 mol H2(g) và mol O2(g) giải phóng nhiệt lượng là 285,8 kJ.
Như vậy, nhiệt tạo thành của nước lỏng: kJ/mol.
Ví dụ 2: Phản ứng N2(g) + O2(g) NO(g) có biến thiên enthalpy: kJ/mol. Giá trị > 0, tức phản ứng này là phản ứng thu nhiệt.
2. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
Ở điều kiện chuẩn: (cđ).
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
Ví dụ 1: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
SO2(g) + O2(g) SO3(l)
biết nhiệt tạo tạo thành của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
Hướng dẫn giải:
= – 441,0 – (–296,8 + 0×) = –144,2 (kJ).
Ví dụ 2: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
4FeS2(s) + 11O2(g) 2Fe2O3(s) + 8SO2(g)
biết nhiệt tạo thành của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
Hướng dẫn giải:
Tổng nhiệt tạo thành các chất ban đầu là:
(cđ) = = (–177,9)×4 + 0×11 = –711,6 (kJ).
Tổng nhiệt tạo thành các chất sản phẩm là:
= (–825,5)×2 + (–296,8)×8 = –4025,4 (kJ).
Vậy, biến thiên enthalpy của phản ứng:
(cđ) = –4025,4 – (–711,6) = –3313,8 (kJ).
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Câu hỏi 2 trang 83 Hóa học 10: Cho các phương trình nhiệt hóa học:...
Câu hỏi 3 trang 83 Hóa học 10: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học