Với giải Bài 4 trang 45 Hóa học lớp 10 Cánh diều chi tiết trong Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Bài 4 trang 45 Hóa học 10: Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:
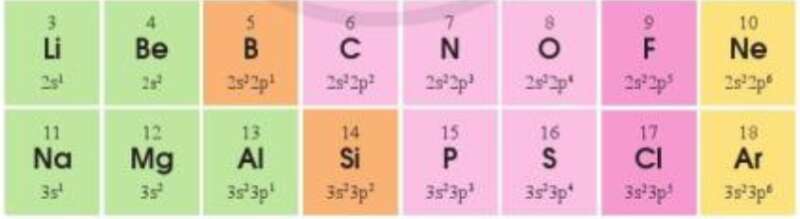
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố ở chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi tính chất hóa học của đơn chất và hợp chất.
Lời giải:
a)
- Ở chu kì 2: theo chiều tăng dần của điện tích hạt nhân
⟹ Số lớp electron ngoài cùng tăng từ 2s1 đến 2s22p6
- Ở chu kì 3: tương tự chu kì 2, theo chiều tăng dần của điện tích hạt nhân
⟹ Số lớp electron ngoài cùng tăng từ 3s1 đến 3s23p6
Vậy sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố ở chu kì 2 và 3 thể hiện như sau: đầu chu kì nguyên tố có cấu hình electron là ns1, cuối mỗi chu kì nguyên tố có cấu hình electron là ns2np6.
b*) - Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3.
Vì cấu hình electron lớp ngoài cùng quyết định khả năng nhường và nhận e để đạt cấu hình của nguyên tố khí hiếm bền vững, dẫn tính kim loại hay phi kim của đơn chất. Trong 1 chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần, tính phi kim giảm dần.
Từ đó, có sự biến đổi tuần hoàn tính acid, base của oxide cao nhất và hydroxide của các nguyên tố (ở hóa trị cao nhất) trong một chu kì.
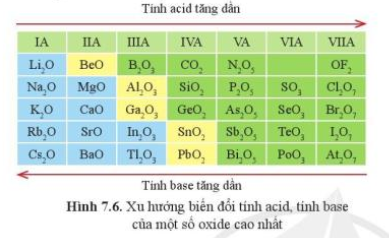
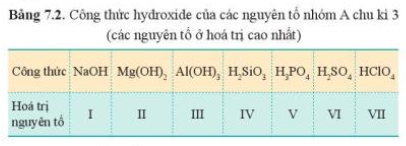
+ Đơn chất: theo chiều tăng dần điện tích hạt nhân thì tính kim loại tăng dần từ và tính phi kim tăng dần (trừ Ar).- Ví dụ sự biến đổi tính chất hóa học của đơn chất và hợp chất của nguyên tố chu kì 3:
Na chỉ cần nhường 1 electron để đạt cấu hình khí hiếm.
⟹ Na là kim loại mạnh nhất, có khả năng tác dụng với H2O ở điều kiện thường:
2Na + 2H2O → 2NaOH + H2
Mg chỉ tác dụng với H2O khi đun nóng:
Mg + 2H2O Mg(OH)2 + H2
+ Hợp chất: theo chiều tăng dần điện tích hạt nhân thì tính base của oxide và hydroxide giảm dần.
Na2O tan trong nước ở điều kiện thường tạo dung dịch base:
Na2O + H2O → 2NaOH
MgO và Al2O3 không tan được trog nước.
Bài tập vận dụng:
Câu 1. Theo độ âm điện của Pauling, nguyên tử có độ âm điện lớn nhất trong bảng tuần hoàn là
A. F
B. H
C. He
D. O
Đáp án: A
Giải thích:
Theo độ âm điện của Pauling, nguyên tử có độ âm điện lớn nhất trong bảng tuần hoàn là
F.
Câu 2. Cho χ(H) = 2,2; χ(C) = 2,55; χ(N) = 3,04; χ(O) = 3,44; χ(F) = 3,98. Cặp electron liên kết bị lệch nhiều nhất trong phân tử nào dưới đây?
A. NH3
B. H2O
C. HF
D. CH4
Đáp án: C
Giải thích:
Trong phân tử NH3 nguyên tử N hút electron liên kết mạnh hơn H gấp 3,04 : 2,2 ≈ 1,38 lần.
Trong phân tử H2O nguyên tử O hút electron liên kết mạnh hơn H gấp 3,44 : 2,2 ≈ 1,56 lần.
Trong phân tử HF nguyên tử F hút electron liên kết mạnh hơn H gấp 3,98 : 2,2 ≈ 1,81 lần.
Trong phân tử CH4 nguyên tử C hút electron liên kết mạnh hơn H gấp 2,55 : 2,2 ≈ 1,16 lần.
Vậy cặp electron liên kết bị lệch nhiều nhất trong phân tử HF.
Câu 3. Khẳng định nào dưới đây sai khi nói về các nguyên tố nhóm A?
A. Theo chiều tăng dần của điện tích hạt nhân, tính kim loại của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
B. Theo chiều tăng dần của điện tích hạt nhân, tính phi kim của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
C. Theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide và hydroxide có xu hướng tăng dần trong một chu kì.
D. Theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide có xu hướng giảm dần trong một chu kì.
Đáp án: A
Giải thích:
- Theo chiều tăng dần của điện tích hạt nhân, tính kim loại của nguyên tử nguyên tố hóa học có xu hướng tăng trong cùng một nhóm và giảm trong cùng một chu kì. ⇒ Khẳng định A sai.
- Theo chiều tăng dần của điện tích hạt nhân, tính phi kim của nguyên tử nguyên tố hóa học có xu hướng giảm trong cùng một nhóm và tăng trong cùng một chu kì.
- Theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide và hydroxide có xu hướng tăng dần trong một chu kì.
- Theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide có xu hướng giảm dần trong một chu kì.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi...
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học