Với giải Vận dụng trang 43 Hóa học lớp 10 Cánh diều chi tiết trong Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi.
Phương pháp giải:
- Chậu làm bằng nhốm có lớp oxide Al2O3 bám ở bên ngoài bảo vệ, vì vậy khá bền trong nước và không khí.
- Dựa vào tính chất hóa học của Al và Al2O3 (có tính lưỡng tính tác dụng được với cả dung dịch acid và dung dịch base) để giải thích vì sao không dùng chậu nhôm đựng nước vôi tôi.
Lời giải:
- Chậu làm bằng nhốm có lớp oxide Al2O3 bám ở bên ngoài bảo vệ, vì vậy khá bền trong nước và không khí. Nước vôi tôi có thành phần là Ca(OH)2
- Tuy nhiên, khi ta dùng khi ta dùng để đựng vôi, nước vôi thì xô, chậu, nhôm bị mòn, thủng vì:
Thành phần của vôi, nước vôi Ca(OH)2, chất này có thể tác dụng được với Al2O3, phá hủy lớp oxide bảo vệ bên ngoài, sau đó tác dụng được với lớp nhôm bên trong gây mòn, thủng.
Vì vậy không dùng đồ dùng bằng nhôm để đựng vôi, nước vôi.
- Phương trình hóa học:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2
Lý thuyết Xu hướng biến đổi thành phần và tính acid, tính base của các oxide và các hydroxide theo chu kì
1. Thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
- Oxide cao nhất của một nguyên tố là oxide mà trong đó, hóa trị của nguyên tố đó là cao nhất. Các nguyên tố thuộc các nhóm IA đến VIIA (trừ fluorine) có hóa trị cao nhất đúng bằng số thứ tự nhóm.
- Công thức oxide cao nhất và hóa trị của các nguyên tố nhóm A, chu kì 3 được thể hiện trong bảng 3.1.
Bảng 3.1. Công thức oxide cao nhất của các nguyên tố nhóm A, chu kì 3
|
Oxide cao nhất |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
|
Hóa trị nguyên tố |
I |
II |
III |
IV |
V |
VI |
VII |
- Xu hướng biến đổi thành phần của các oxide cao nhất: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tỉ số giữa số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất có xu hướng tăng dần.
Ví dụ: Trong chu kì 3, theo chiều tăng dần của điện tích hạt nhân, tỉ số giữa số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất tăng dần theo thứ tự , , , , , , .
- Xu hướng biến đổi tính acid, tính base của oxide cao nhất: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
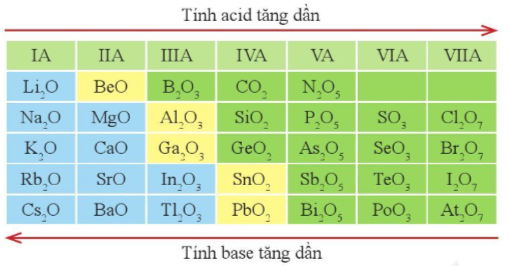
Hình 7.6. Xu hướng biến đổi tính acid, tính base của một số oxide cao nhất
Ví dụ: Trong chu kì 3, Cl2O7 có tính acid mạnh nhất, Na2O có tính base mạnh nhất và Al2O3 vừa có tính acid, vừa có tính base.
Lưu ý:
- Không tồn tại hợp chất F2O7, oxide thường gặp của F có công thức là F2O.
- Quy luật về sự biến đổi chung của tính acid và tính base của oxide cao nhất ngược chiều nhau trong mỗi chu kì và nhóm.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, nói chung tính base của oxide cao nhất tăng dần .
- Al2O3 có tính lưỡng tính: tác dụng được với cả dung dịch acid và dung dịch base.
2. Thành phần và tính acid, tính base của các hydroxide cao nhất trong một chu kì
- Hydroxide của nguyên tố kim loại M hóa trị n có dạng M(OH)n. Đối với nguyên tố phi kim hydroxide của nó ở dạng acid.
Bảng 3.2. Công thức hydroxide của các nguyên tố nhóm A, chu kì 3 (các nguyên tố ở hóa trị cao nhất)
|
Công thức hydroxide |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
|
Hóa trị nguyên tố |
I |
II |
III |
IV |
V |
VI |
VII |
- Xu hướng biến đổi tính acid, tính base của hydroxide: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
Ví dụ: Trong chu kì 3, NaOH là một base mạnh; Al(OH)3 vừa có tính acid, vừa có tính base; H2SiO3 là acid rất yếu; H3PO4 là acid trung bình; H2SO4 là acid mạnh; HClO4 là acid rất mạnh.
Lưu ý: Acid chứa oxygen có thể được coi là một dạng của hydroxide (không bền) bị mất nước.
Ví dụ: Si(OH)4 H2SiO3 + H2O
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học