Với giải Câu hỏi 4 trang 41 Hóa học lớp 10 Cánh diều chi tiết trong Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Câu hỏi 4 trang 41 Hóa học 10: Cặp electron liên kết bị lệch nhiều hơn trong phân tử NH3 hay trong phân tử H2O? Vì sao?
Phương pháp giải:
- Tính tỉ lệ chênh lệch độ âm điện giữa N : H và O : H.
- Tỉ lệ chênh lệch độ âm điện càng lớn thì cặp electron liên kết càng bị lệch nhiều.
Lời giải:
- Trong phân tử NH3: độ âm điện của H và N lần lượt là 2,2 và 3,0
⟹ Nguyên tử N hút electron liên kết mạnh hơn H gấp 3,0 : 2,2 = 1,36 lần.
- Trong phân tử H2O: độ âm điện của H và O lần lượt là 2,2 và 3,4
⟹ Nguyên tử O hút electron liên kết mạnh hơn H gấp 3,4 : 2,2 = 1,54 lần.
Vậy cặp electron liên kết trong phân tử H2O bị lệch nhiều hơn trong phân tử H2O.
Lý thuyết Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
1. Độ âm điện
- Độ âm điện (χ – đọc là khi) là đại lượng đặc trưng cho khả năng hút electron liên kết của nguyên tử.
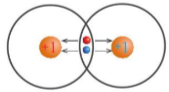
Hình 7.3. Cặp electron liên kết bị các nguyên tử hút về phía các hạt nhân của mỗi nguyên tử H
Lưu ý: Electron hóa trị đã tham gia hình thành liên kết hóa học thì gọi là electron liên kết.
- Độ âm điện được sử dụng rộng rãi là độ âm điện theo Pauling. Theo đó nguyên tử có độ âm điện lớn nhất là fluorine, χ(F) = 3,98.
- Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.

Hình 7.4. Giá trị độ âm điện của một số nguyên tố nhóm A và quy luật biến đổi độ âm điện
- Độ âm điện phụ thuộc đồng thời vào hai yếu tố: điện tích hạt nhân và bán kính nguyên tử.
- Giải thích:
+ Trong một chu kì, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần nên khả năng hút cặp electron liên kết càng tăng, dẫn tới độ âm điện càng tăng.
+ Trong một nhóm, từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng lên nên lực hút của hạt nhân tới cặp electron liên kết giảm, dẫn tới độ âm điện giảm.
Chú ý: Theo biểu thức , lực hút F giảm theo r2 và tăng theo Z, nghĩa là ảnh hưởng của r lớn hơn của Z tới lực hút của hạt nhân với electron.
2. Tính kim loại và tính phi kim
- Tính kim loại đặc trưng bởi khả năng nhường electron của nguyên tử.
- Tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử.
- Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
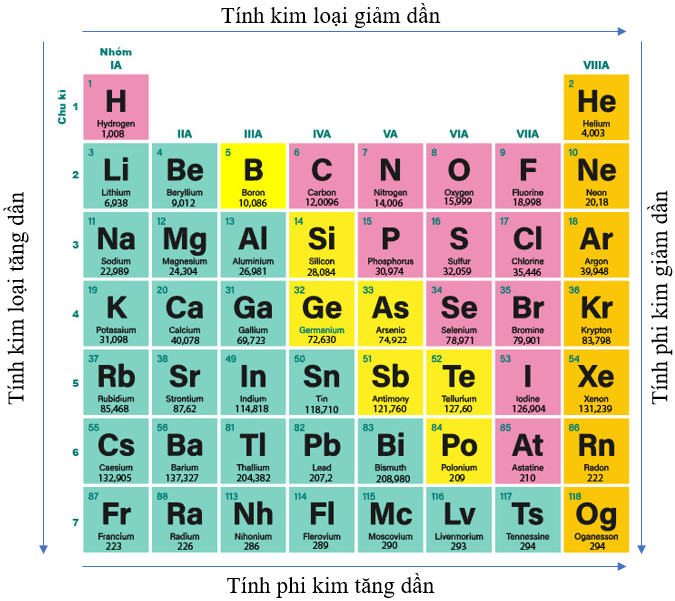
Hình 7.5. Quy luật biến đổi tính kim loại, tính phi kim
- Giải thích:
+ Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron hóa trị tăng, làm giảm khả năng nhường electron, do đó tính kim loại của nguyên tố giảm.
+ Trong một nhóm A, mặc dù điện tích hạt nhân tăng dần nhưng do bán kính nguyên tử của các nguyên tố tăng nhanh, nên lực hút của hạt nhân tới electron hóa trị giảm dần, làm tăng khả năng nhường electron, do đó tính kim loại của nguyên tố tăng.
Lưu ý: Tính kim loại và tính phi kim luôn biến đổi ngược chiều nhau. Độ âm điện và tính phi kim của các nguyên tử của nguyên tố hóa học biến đổi cùng chiều trong một chu kì và trong một nhóm.
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi...
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học