Với giải Luyện tập 1 trang 39 Hóa học lớp 10 Cánh diều chi tiết trong Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
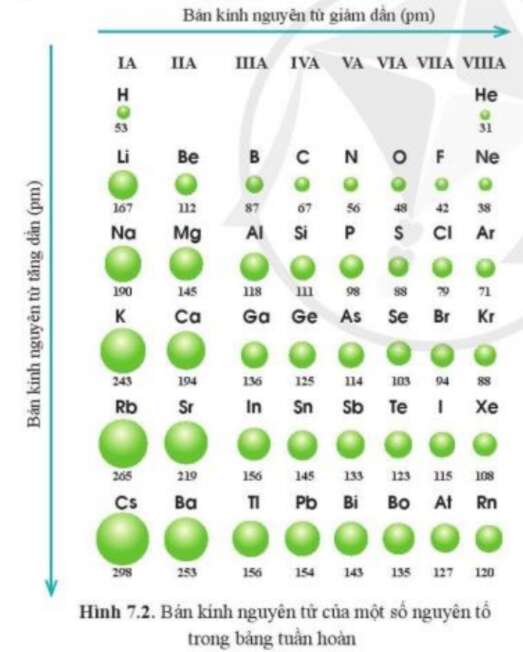
Luyện tập 1 trang 39 Hóa học 10: Quan sát hình 7.2, cho biết quy luật biến đổi bán kính nguyên tử của các nguyên tố ở chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
Phương pháp giải:
Quan sát bán kính nguyên tử các nguyên tố chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
Lời giải:
Các nguyên tố chu kì 3, 4,5 theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần từ trái quá phải.
Lý thuyết Xu hướng biến đổi bán kính nguyên tử
1. Trong một chu kì
- Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần.
- Giải thích: Nguyên tử các nguyên tố trong cùng chu kì có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính nguyên tử giảm.
Ví dụ: Trong chù kì 2, bán kính nguyên tử của các nguyên tố giảm dần theo thứ tự: Li, Be, B, C, N, O, F.
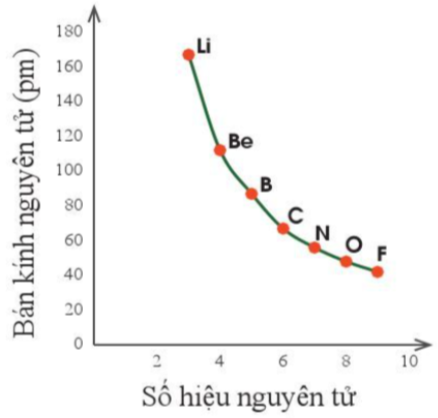
Hình 7.1. Sự thay đổi bán kính nguyên tử theo số hiệu nguyên tử của các nguyên tố chu kì 2
Lưu ý: Bán kính nguyên tử là khoảng cách từ hạt nhân đến electron ở lớp vỏ ngoài cùng.
2. Trong một nhóm A
- Quy luật chung đối với các nguyên tố nhóm A: Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng tăng dần.
- Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, bán kính nguyên tử tăng dần, nguyên nhân chủ yếu là do số lớp electron tăng dần.
Ví dụ: Trong nhóm IIA, bán kính nguyên tử của các nguyên tố tăng dần theo thứ tự: Be, Mg, Ca, Sr, Ba.
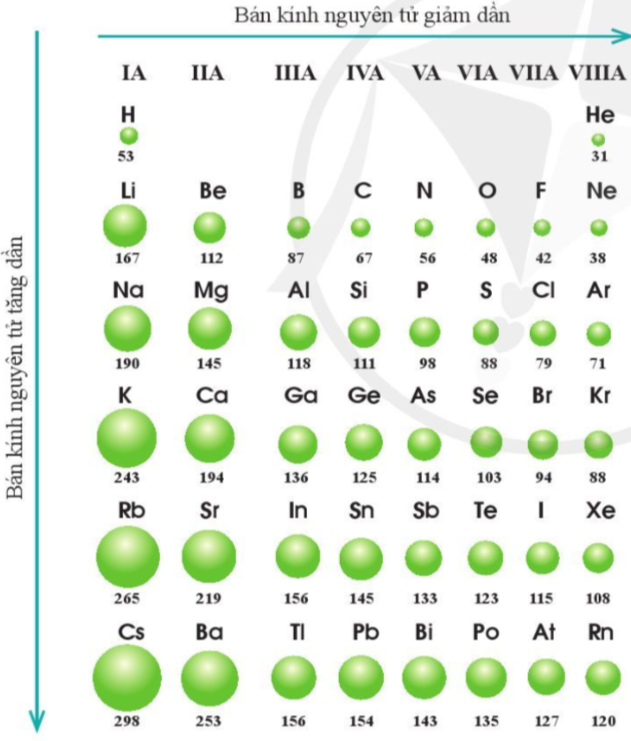
Hình 7.2. Bán kính nguyên tử (pm) của một số nguyên tố trong bảng tuần hoàn
Xem thêm lời giải bài tập Hóa Học 10 Cánh diểu hay, chi tiết khác:
Vận dụng trang 43 Hóa học 10: Giải thích vì sao không dùng chậu nhôm để đựng nước vôi tôi...
Bài 1 trang 45 Hóa học 10: Hoàn thành chỗ trống trong các câu sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học