Với giải Bài 2 trang 119 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 18: Hydrogen halide và một số phản ứng của ion halidegiúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
Bài 2 trang 119 Hóa học 10: Trong phòng thí nghiệm, một khí hydrogen halide (HX) được điều chế theo phản ứng sau:
NaX(khan) + H2SO4(đặc) HX↑ + NaHSO4 (hoặc Na2SO4)
a) Cho biết HX là chất nào trong các chất sau: HCl, HBr, HI. Giải thích.
b) Có thể dụng dung dịch NaX và H2SO4 loãng để điều chế HX theo phản ứng trên được không. Giải thích
Phương pháp giải:
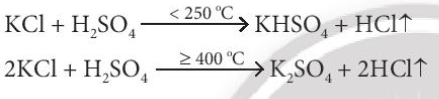
![]()
Lời giải:
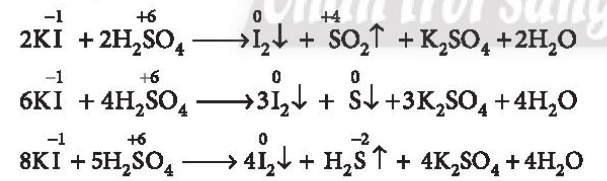
a) Khi phản ứng với H2SO4 đặc, NaI và NaBr đều bị oxi hóa thành I2 và Br2. Chỉ có NaCl tác dụng với H2SO4(đặc) tạo ra HCl
=> X là Cl
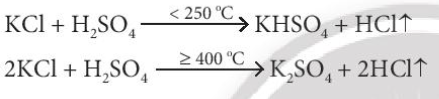
b) Không thể dùng H2SO4 loãng vì HX đều là những acid mạnh
Bài tập vận dụng:
Câu 1. Cho phản ứng: NaCl + H2SO4 đặc
Sản phẩm thu được là
A. NaHSO4 và HCl;
B. Cl2, SO2, Na2SO4 và H2O;
C. Na2SO4 và HCl;
D. Không phản ứng.
Đáp án đúng là: C
2NaCl + H2SO4 đặc Na2SO4 + 2HCl ↑
Câu 2. Khi phản ứng với sulfuric acid đặc thì:
(1) Ion Cl− khử H2SO4 trong dung dịch H2SO4 đặc thành SO2.
(2) Ion Br− khử H2SO4 trong dung dịch H2SO4 đặc thành SO2.
(3) Ion I− khử H2SO4 trong dung dịch H2SO4 đặc thành H2S, S, SO2 tùy vào điều kiện phản ứng.
Khẳng định đúng là
A. (1)
B. (1), (2) và (3)
C. (2) và (3)
D. (1) và (2)
Đáp án đúng là: C
Khi phản ứng với sulfuric acid đặc thì:
(1) Ion Cl− khử H2SO4 trong dung dịch H2SO4 đặc thành SO2 ⇒ sai. Vì ion Cl− không khử được H2SO4 nên chỉ xảy ra phản ứng trao đổi.
(2) Ion Br− khử H2SO4 trong dung dịch H2SO4 đặc thành SO2 ⇒ đúng.
(3) Ion I− khử H2SO4 trong dung dịch H2SO4 đặc thành H2S, S, SO2 tùy vào điều kiện phản ứng ⇒ đúng.
Câu 3. Hydrohalic acid có tính acid mạnh nhất là
A. Hydrochloric acid;
B. Hydrofluoric acid;
C. Hydrobromic acid;
D. Hydroiodic acid.
Đáp án đúng là: D
Tính acid của các hydrohalic acid tăng dần từ hydrochloric acid (HF) đến hydroiodic acid (HI).
Do đó hydroiodic acid có tính acid mạnh nhất.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 116 Hóa học 10: Phản ứng nào dưới đây chứng minh tính khử của các ion halide:...
Câu hỏi 6 trang 117 Hóa học 10: Tiến hành thí nghiệm và quan sát hiện tượng. Dựa vào phương trình hóa học của các phản ứng, nêu cách nhận biết các ion halide trong dung dịch... Câu hỏi 7 trang 118 Hóa học 10: Tìm những ứng dụng khác của hydrogen halide trong đời sống, sản xuất...Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học