Với giải Luyện tập trang 117 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 18: Hydrogen halide và một số phản ứng của ion halidegiúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
Luyện tập trang 117 Hóa học 10: Nêu cách nhận biết 2 dung dịch CaCl2 và NaNO3, viết phương trình hóa học của phản ứng xảy ra
Phương pháp giải:
Sử dụng muối AgNO3
Lời giải:
- 2 dung dịch CaCl2 và NaNO3 cho vào 2 ống nghiệm:
+ Mỗi ống nghiệm cho khoảng 2 mL AgNO3. Ống nghiệm nào xuất hiện kết tủa trắng thì đó là dung dịch CaCl2, ống nghiệm nào không có hiện tượng gì thì đó là dung dịch NaNO3
CaCl2 + 2AgNO3 → 2AgCl↓ + Ca(NO3)2
Lý thuyết Nhận biết ion halide trong dung dịch
- Phân biệt các ion F-, Cl-, Br- và I- bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng.
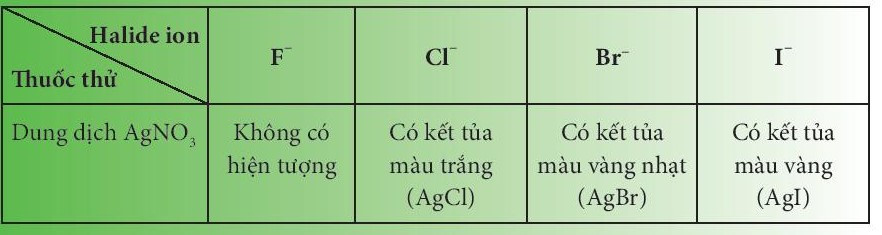
- Phương trình hóa học minh họa:
NaF + AgNO3 → không phản ứng
NaCl + AgNO3 → AgCl↓ + NaNO3
NaBr + AgNO3 → AgBr↓ + NaNO3
NaI + AgNO3 → AgI↓ + NaNO3

Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 116 Hóa học 10: Phản ứng nào dưới đây chứng minh tính khử của các ion halide:...
Câu hỏi 6 trang 117 Hóa học 10: Tiến hành thí nghiệm và quan sát hiện tượng. Dựa vào phương trình hóa học của các phản ứng, nêu cách nhận biết các ion halide trong dung dịch...Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học