Với giải Câu hỏi 13 trang 64 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 10: Liên kết cộng hóa trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 10: Liên kết cộng hóa trị
Câu hỏi 13 trang 64 Hóa học 10: Mô tả sự hình thành liên kết п
Phương pháp giải:
Liên kết п là sự xen phủ bên
Lời giải:
Liên kết п hay còn là sự xen phủ bên: Sự xen phủ thực hiện ở hai bên trục nối giữa hai hạt nhân nguyên tử
Ví dụ:
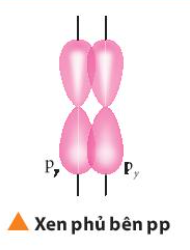
Lý thuyết Sự hình thành liên kết ?, ? và năng lượng liên kết
1. Tìm hiểu sự hình thành liên kết ? và liên kết ?
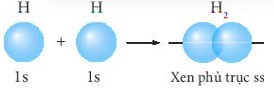
- Liên kết σ là loại liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital. Vùng xen phủ nằm trên đường nối tâm hai nguyên tử.
Ví dụ:
+ Sự xen phủ trục giữa 2 AO 1s của hai nguyên tử hydrogen hình thành liên kết σ trong phân tử H2.
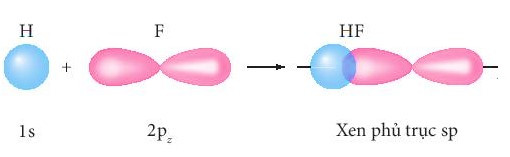
+ Sự xen phủ giữa AO 1s của nguyên tử H và AO 2p của nguyên tử F hình thành liên kết σ trong phân tử HF.
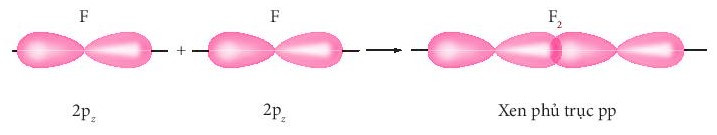
+ Sự xen phủ giữa hai AO 2p của hai nguyên tử fluorine hình thành liên kết σ trong phân tử fluorine.
- Liên kết π là loại liên kết cộng hóa trị được hình thành do sự xen phủ bên của hai orbital. Vùng xen phủ nằm hai bên đường nối tâm hai nguyên tử.
Ví dụ:
Sự xen phủ các AO hình thành liên kết σ và liên kết π trong phân tử oxygen.
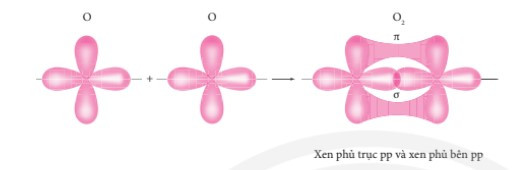
Chú ý:
- Liên kết đơn gồm 1 liên kết σ.
- Liên kết đôi gồm 1 liên kết σ và 1 liên kết π.
- Liên kết ba gồm 1 liên kết σ và hai liên kết π.
- Liên kết σ bền vững hơn liên kết π.
2. Tìm hiểu khái niệm năng lượng liên kết (Eb)
- Năng lượng liên kết của một liên kết hóa học là năng lượng cần thiết để phá vỡ 1 mol liên kết đó ở thể khí, tạo thành các nguyên tử ở thể khí.
- Năng lượng liên kết đặc trưng cho độ bền liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền và ngược lại.
Ví dụ:
N2(g) → 2N(g) Eb = 945 kJ/ mol
Ta nói năng lượng liên kết trong phân ử N2 là 945 kJ/ mol. Điều này có nghĩa cần cung cấp 945 kJ để phá vỡ 1 mol khí N2 thành các nguyên tử ở thể khí.
- Đối với các phân tử nhiều nguyên tử, tổng năng lượng liên kết trong phân tử bằng năng lượng cần cung cấp để phá vỡ hoàn toàn 1 mol phân tử đó ở thể khí thành các nguyên tử ở thể khí.
Ví dụ:
Tổng năng lượng liên kết trong phân tử CH4 là 1660 kJ/ mol.
CH4 (g) → C(g) + 4H(g) Eb = 1660 kJ/ mol
Do đó, năng lượng liên kết trung bình của một liên kết C – H là:
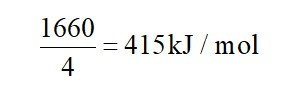
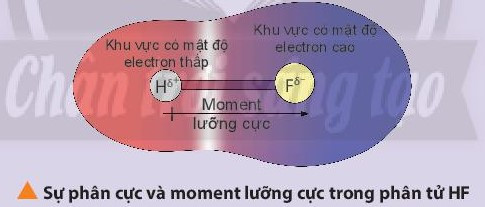
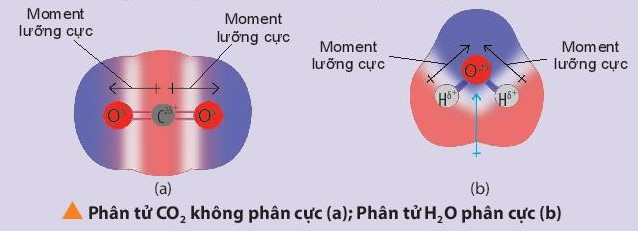
Chú ý: Nhận biết phân tử phân cực và phân tử không phân cực:
+ Phân tử phân cực là phân tử có tổng tất cả moment lưỡng cực trong phân tử khác không. Các phân tử phân cực thường tan tốt trong nước và các dung môi phân cực khác.
+ Phân tử không phân cực là phân tử có tổng tất cả các moment lưỡng cực trong phân tử bằng không. Phân tử không phân cực thường hòa tan tốt trong các dung môi không phân cực.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 3 trang 60 Hóa học 10: Thế nào là liên kết đơn, liên kết đôi và liên kết ba?...
Luyện tập 1 trang 60 Hóa học 10: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử Cl2
Luyện tập 2 trang 60 Hóa học 10: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3
Luyện tập trang 63 Hóa học 10: Cho biết loại liên kết trong các phân tử MgCl2, CO2 và C2H4.
Câu hỏi 12 trang 63 Hóa học 10: Mô tả sự hình thành liên kết σ...
Câu hỏi 20 trang 66 Hóa học 10: Trình bày các bước trong quá trình lắp ráp mô hình phân tử NH3...
Câu hỏi 21 trang 66 Hóa học 10: Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?...
Bài 3 trang 66 Hóa học 10: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
Bài 7 trang 66 Hóa học 10: Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2)....
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học