Với giải Câu hỏi 9 trang 62 Hóa học lớp 10 Chân trời sáng tạo chi tiết tron Bài 10: Liên kết cộng hóa trị giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 10: Liên kết cộng hóa trị
Câu hỏi 9 trang 62 Hóa học 10: Liên kết cộng hóa trị trong phân tử dạng A2 luôn là liên kết cộng hóa trị phân cực hay không phân cực? Giải thích.
Phương pháp giải:
Dựa vào Bảng 10.2 và rút ra nhận xét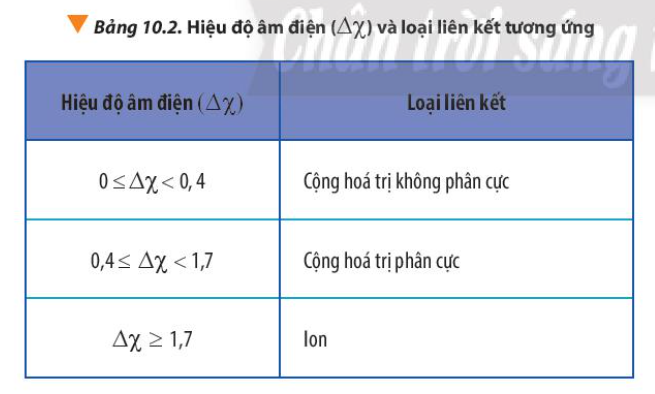
Lời giải:
- Phân tử dạng A2 được tạo bởi 2 nguyên tử giống nhau
=> Hiệu độ âm điện = 0
=> Cộng hóa trị không phân cực
=> Liên kết cộng hóa trị trong phân tử dạng A2 luôn là liên kết cộng hóa trị không phân cực
Lý thuyết Phân biệt các loại liên kết dựa theo độ âm điện
1. Phân biệt liên kết cộng hóa trị phân cực và không phân cực
- Liên kết cộng hóa trị không phân cực là liên kết cộng hóa trị trong đó cặp electron chung không lệch về phía nguyên tử nào.
Ví dụ: Liên kết cộng hóa trị trong các phân tử H2, Br2 là liên kết cộng hóa trị không phân cực.
![]()
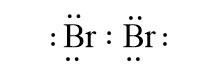
- Liên kết cộng hóa trị phân cực là liên kết cộng hóa trị trong đó cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
Ví dụ: Liên kết cộng hóa trị trong các phân tử HBr, H2O là liên kết cộng hóa trị phân cực.
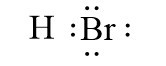
![]()
2. Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
- Có thể dựa vào hiệu độ âm điện (∆χ) giữa hai nguyên tử tham gia liên kết để dự đoán loại liên kết giữa chúng.
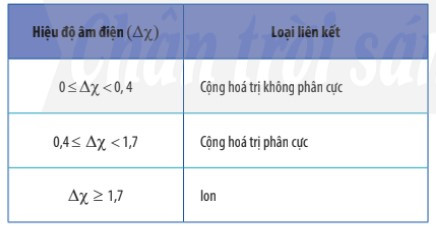
Ví dụ:
+ Trong phân tử MgCl2
![]()
⇒ Liên kết Mg-Cl trong phân tử MgCl2 là liên kết ion.
+ Trong phân tử CO2
![]()
⇒ Liên kết C=O trong phân tử CO2 là liên kết cộng hóa trị phân cực.
+ Trong phân tử C2H4
![]()
⇒ Liên kết C-H trong phân tử C2H4 là liên kết cộng hóa trị không phân cực.
Xem thêm lời giải bài tập Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 3 trang 60 Hóa học 10: Thế nào là liên kết đơn, liên kết đôi và liên kết ba?...
Luyện tập 1 trang 60 Hóa học 10: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử Cl2
Luyện tập 2 trang 60 Hóa học 10: Trình bày sự hình thành liên kết cộng hóa trị trong phân tử NH3
Luyện tập trang 63 Hóa học 10: Cho biết loại liên kết trong các phân tử MgCl2, CO2 và C2H4.
Câu hỏi 12 trang 63 Hóa học 10: Mô tả sự hình thành liên kết σ...
Câu hỏi 13 trang 64 Hóa học 10: Mô tả sự hình thành liên kết п...
Câu hỏi 16 trang 64 Hóa học 10: Sự xen phủ có sự tham gia của orbital nào luôn là xen phủ trục?...
Câu hỏi 20 trang 66 Hóa học 10: Trình bày các bước trong quá trình lắp ráp mô hình phân tử NH3...
Câu hỏi 21 trang 66 Hóa học 10: Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?...
Bài 3 trang 66 Hóa học 10: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
Bài 7 trang 66 Hóa học 10: Cho biết số liên kết σ và liên kết п trong phân tử acetylene (C2H2)....
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học