Với tóm tắt lý thuyết Hóa học lớp 12 Bài 18: Nguyên tố nhóm IIA sách Cánh diều hay, chi tiết cùng với 10 bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa học 12 Bài 18: Nguyên tố nhóm IIA
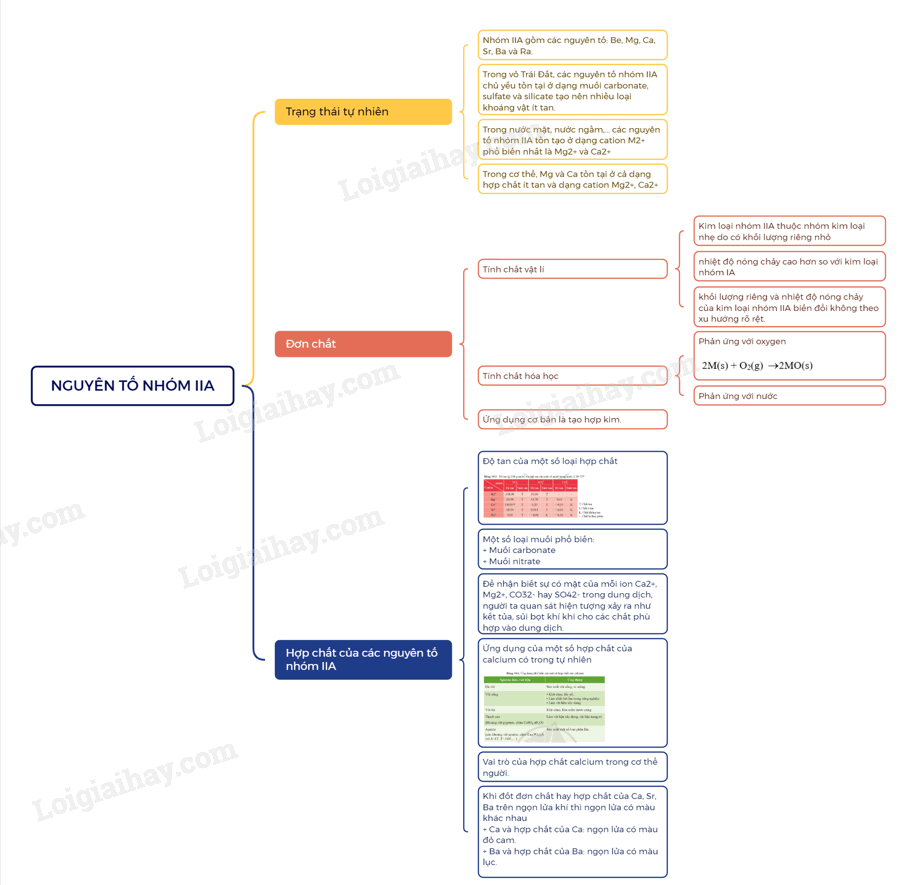
A. Lý thuyết Nguyên tố nhóm IIA
I. Trạng thái tự nhiên
- Nhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra.
- Trong vỏ Trái Đất, các nguyên tố nhóm IIA chủ yếu tồn tại ở dạng muối carbonate, sulfate và silicate tạo nên nhiều loại khoáng vật ít tan.
- Trong nước mặt, nước ngầm,… các nguyên tố nhóm IIA tồn tạo ở dạng cation M2+ phổ biến nhất là Mg2+ và Ca2+
- Trong cơ thể, Mg và Ca tồn tại ở cả dạng hợp chất ít tan và dạng cation Mg2+, Ca2+
II. Đơn chất
1. Tính chất vật lí
- Bán kính nguyên tử và một số tính chất vật lí của kim loại nhóm IIA được thể hiện qua bảng sau:
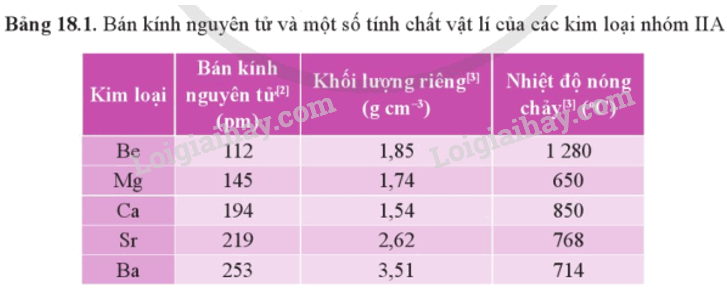
- Kim loại nhóm IIA thuộc nhóm kim loại nhẹ do có khối lượng riêng nhỏ. Chúng có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA, nhưng tương đối thấp so với các kim loại khác.
- Khác với kim loại kiềm, khối lượng riêng và nhiệt độ nóng chảy của kim loại nhóm IIA biến đổi không theo xu hướng rõ rệt.
2. Tính chất hóa học
a) Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau:
2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
b) Phản ứng với nước
Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường.
3. Ứng dụng
Ứng dụng cơ bản của một số kim loại nhóm IIA là tham gia tạo hợp kim.
III. Hợp chất của các nguyên tố nhóm IIA
1. Độ tan của một số loại hợp chất
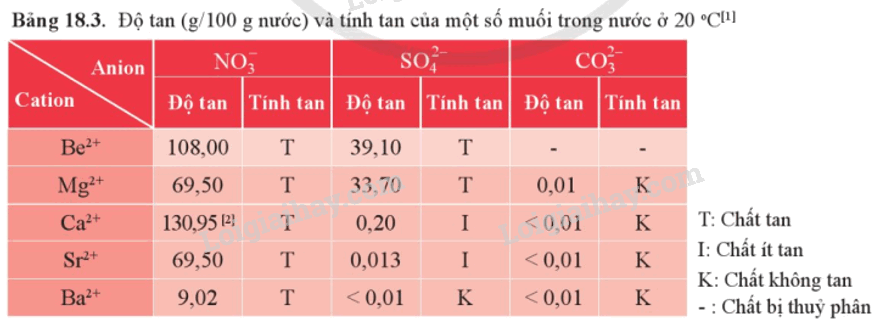
2. Một số loại muối phổ biến
a) Muối carbonate
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan.
Ví dụ: CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
- Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
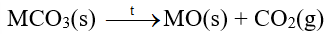
b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen.
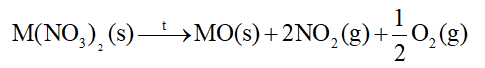
- Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2.
3. Kiểm tra sự có mặt của ion trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, CO32- hay SO42- trong dung dịch, người ta quan sát hiện tượng xảy ra như kết tủa, sủi bọt khí khi cho các chất phù hợp vào dung dịch.
4. Ứng dụng và vai trò của một số hợp chất của calcium
a) Ứng dụng của một số hợp chất của calcium có trong tự nhiên
thạch cao, apatite, đá vôi, vôi sống, vôi tôi có thành phần chính là các hợp chất của calcium. Chúng là nguyên liệu, vật liệu phổ biến và có nhiều ứng dụng trong đời sống, sản xuất.

b) Vai trò của hợp chất calcium trong cơ thể người
Trong cơ thể người:
+ Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
+ Một số hợp chất tan của calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp.
IV. Nhận biết kim loại và ion kim loại nhóm IIA
Khi đốt đơn chất hay hợp chất của Ca, Sr, Ba trên ngọn lửa khí thì ngọn lửa có màu khác nhau
+ Ca và hợp chất của Ca: ngọn lửa có màu đỏ cam.
+ Ba và hợp chất của Ba: ngọn lửa có màu lục.
Sơ đồ tư duy nhóm IIA
B. Trắc nghiệm Nguyên tố nhóm IIA
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Có thể nhận biết dung dịch BaCl2 bằng dung dịch chất nào sau đây?
A. NaOH.
B. Na2CO3.
C. NaCl.
D. NaNO3.
Đáp án đúng là: B
Có thể nhận biết dung dịch BaCl2 bằng dung dịch Na2CO3.
Hiện tượng: Xuất hiện kết tủa trắng.
Câu 2: Muối nào sau đây chỉ tồn tại trong dung dịch và bị phân huỷ khi đun nóng?
A. Ca(NO3)2.
B. CaSO4.
C. CaCl2.
D. Ca(HCO3)2.
Đáp án đúng là: D
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Câu 3: Khi đốt nóng tinh thể BaCl2 trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu
A. tím nhạt.
B. đỏ son.
C. đỏ cam.
D. lục vàng.
Đáp án đúng là: D
Khi đốt nóng tinh thể BaCl2 trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu lục vàng.
Câu 4: Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi như thế nào?
A. Tăng dần.
B. Giảm dần.
C. Không có quy luật.
D. Không đổi.
Đáp án đúng là: B
Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi giảm dần.
Câu 5: Cho dung dịch HCl vào dung dịch X thấy sủi bọt khí, nếu cho dung dịch Ca(OH)2 vào dung dịch X sinh ra kết tủa. Dung dịch X là
A. Na2SO4.
B. KNO3.
C. Ca(HCO3)2.
D. BaCl2.
Đáp án đúng là: C
Dung dịch X là: Ca(HCO3)2.
Phương trình hóa học minh họa:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + H2O
Câu 6: Nguyên tố calcium đóng vai trò thiết yếu cho việc phát triển xương, góp phần duy trì hoạt động của cơ bắp, truyền dẫn thần kinh, tăng cường khả năng miễn dịch. Trong cơ thể người, phần lớn calcium tập trung ở
A. xương.
B. răng.
C. cơ.
D. móng.
Đáp án đúng là: A
Trong cơ thể người, phần lớn calcium tập trung ở xương.
Câu 7: Ở nơi tồn ứ rác thải, chất nào sau đây được các công nhân vệ sinh môi trường dùng để xử lí tạm thời nhằm sát trùng, diệt khuẩn, phòng chống dịch bệnh?
A. Cát vàng.
B. Than đá.
C. Đá vôi.
D. Vôi bột.
Đáp án đúng là: D
Ở nơi tồn ứ rác thải, vôi bột được các công nhân vệ sinh môi trường dùng để xử lí tạm thời nhằm sát trùng, diệt khuẩn, phòng chống dịch bệnh.
Câu 8: Khi đun nóng đến 160 °C, thạch cao sống mất một phần nước trở thành thạch cao nung, được dùng để đúc khuôn trong điêu khắc, bó bột trong y học. Thành phần chính của thạch cao nung là
A. CaSO4.0,5H2O.
B. Ca(H2PO4)2.
C. CaCO3.
D. Ca(OH)2.
Đáp án đúng là: A
Thành phần chính của thạch cao nung là CaSO4.0,5H2O.
Câu 9: Trong nông nghiệp, trộn urea hoặc phân đạm ammonium với chất nào sau đây thì sẽ làm giảm đáng kể tác dụng của phân đạm?
A. KNO3.
B. Ca(H2PO4)2.
C. Ca(OH)2.
D.CaCl2.
Đáp án đúng là: C
Trong nông nghiệp, trộn urea hoặc phân đạm ammonium với Ca(OH)2 sẽ làm giảm đáng kể tác dụng của phân đạm do làm thất thoát nitrogen.
OH- + NH4+ → NH3 + H2O
Câu 10: Hiện tượng “nước chảy đá mòn” và hiện tượng “xâm thực” của nước mưa vào các phiến đá vôi là do trong nước có hoà tan khí nào sau đây?
A. O2.
B. N2.
C. CO2.
D. CH4.
Đáp án đúng là: C
Hiện tượng “nước chảy đá mòn” và hiện tượng “xâm thực” của nước mưa vào các phiến đá vôi là do trong nước có hoà tan khí CO2.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d mỗi câu, hãy chọn đúng hoặc sai.
Câu 11: Cho độ tan của các hydroxide kim loại nhóm IIA ở 20 oC như sau:
|
Hydroxide |
Mg(OH)2 |
Ca(OH)2 |
Sr(OH)2 |
Ba(OH)2 |
|
Độ tan (g/100 gam nước) |
0,00125 |
0,173 |
1,77 |
3,89 |
a) Độ tan của các hydroxide giảm dần từ Mg(OH)2 đến Ba(OH)2.
b) Mức độ phản ứng với nước tăng dần từ Mg đến Ba.
c) Ở 20 oC, nồng độ dung dịch Ba(OH)2 bão hòa là 3,89%.
d) Mg(OH)2 là chất không tan, Ca(OH)2 là chất ít tan.
a) Sai. Độ tan của các hydroxide tăng dần từ Mg(OH)2 đến Ba(OH)2.
b) Đúng. Mức độ phản ứng với nước tăng dần từ Mg đến Ba.
c) Sai. Ở 20 oC:
d) Đúng. Mg(OH)2 là chất không tan, Ca(OH)2 là chất ít tan do Mg(OH)2 có độ tan (S) < 0,01 còn Ca(OH)2 có 0,01 < S < 1.
Câu 12. Trong bảng Hệ thống tuần hoàn, sodium (IA) và magnesium (IIA) đứng kề nhau trong một chu kì. Thế điện cực chuẩn của cặp Mg2+/Mg bằng –2,356 V, của cặp Na+/Na bằng –2,710 V.
a). Mg và Na là các kim loại có tính khử mạnh.
b). Mg có tính khử mạnh hơn Na.
c). Mg và Na đều phản ứng mãnh liệt với nước ở điều kiện thường.
d). Ion Mg2+ có tính oxi hóa mạnh hơn ion Na+.
a). Đúng.
b). Sai vì Na có thế điện cực chuẩn âm hơn nên có tính khử mạnh hơn Mg.
c). Sai vì Mg phản ứng chậm với nước ở điều kiện thường.
d). Đúng.
Phần III. Trắc nghiệm yêu cầu trả lời ngắn
Câu 13: Ở 20 °C, độ tan trong nước của Ca(OH)2 là 0,173 g trong 100 g nước, ở nhiệt độ này, nước vôi trong bão hoà (coi D = 1 g/mL) có nồng độ mol là a.10-2 mol/L. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần mười).
Đáp án đúng là: 0,0234M
Giải thích:
Độ tan trong nước của Ca(OH)2 là 1,73 g trong 1 lít nước.
Nồng độ mol của nước vôi trong bão hoà: CM = = 0,0234 (M).
Câu 14: Ở điều kiện thường, tinh thể Ca có D = 1,55 g/cm3. Giả thiết các nguyên tử Ca là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng.
Cho biết:
- Công thức tính thể tích hình cầu: V = .π.r3
- Số Avogadro NA= 6,023.1023 và số pi π = 3,1416.
Bán kính nguyên tử Ca là bao nhiêu pm? (Làm tròn kết quả đến phần nguyên).
Đáp án đúng là: 196 pm
Giải thích:
Trong 1 cm3 tinh thể kim loại Ca thì các quả cầu kim loại chiếm thể tích 0,74 cm3 và có khối lượng 1,55 g.
Số quả cầu kim loại = 6,023 . 1023 . = 0,2334. 1023 = 0,02334 . 1024 (quả)
Tổng thể tích của quả cầu kim loại là:
V = .π.r3.0,02334.1024 = 0,74 → r ≈ 1,96 .10-8cm = 196pm.
Câu 15. Nhiệt phân hoàn toàn 40 g một loại quặng dolomite có lẫn tạp chất trơ sinh ra 9,916 lít khí CO2 (điều kiện chuẩn). Thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là bao nhiêu?
Đáp án đúng là: 92.
Giải thích:
0,2 ← 0,4 (mol)
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Lý thuyết Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Lý thuyết Bài 21: Sơ lược về phức chất
Lý thuyết Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch