Với giải Hoạt động thí nghiệm trang 122 Hóa học 12 Kết nối tri thức chi tiết trong Bài 25: Nguyên tố nhóm IIA giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 25: Nguyên tố nhóm IIA
Hoạt động thí nghiệm trang 122 Hóa học 12: Phân biệt từng ion riêng rẽ Ca2+, Ba2+, SO42-, CO32- có trong dung dịch
Chuẩn bị:
Hoá chất: các dung dịch: CaCl2 1 M, BaCl2 1 M, Na2SO4 1 M, Na2CO3 1M, HCl 2 M. Dụng cụ: ống nghiệm, giá ống nghiệm.
Tiến hành:
1. Nhận biết từng ion riêng rẽ
Cho vào ống nghiệm (1) khoảng 1 mL dung dịch CaCl2 1 M, ống nghiệm (2) khoảng 1 mL dung dịch BaCl2 1 M, ống nghiệm (3) khoảng 1 mL Na2SO4 1 M.
- Nhỏ từ từ từng giọt dung dịch Na2SO4 1 M vào mỗi ống nghiệm (1) và ống nghiệm (2); nhỏ vài giọt dung dịch BaCl2 1 M vào ống nghiệm (3).
Chú ý: BaCl2 độc, cần tuân thủ quy tắc an toàn trong phòng thí nghiệm.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
2. Ở ống nghiệm (1) và (2), ống nào tạo kết tủa nhanh hơn? Nhiều hơn?
2. Nhận biết ion
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều.
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Nêu các hiện tượng xảy ra và giải thích.
Lời giải:
1. Nhận biết từng ion riêng rẽ
1. Phương trình hoá học của các phản ứng xảy ra trong mỗi ống nghiệm.
Ống nghiệm 1: CaCl2 + Na2SO4 → CaSO4 + 2NaCl.
Ống nghiệm 2: BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
Ống nghiệm 3: Na2SO4 + BaCl2 → BaSO4 + 2NaCl.
2. Ở ống nghiệm (1) và (2), ống nghiệm (2) tạo kết tủa nhanh hơn, nhiều hơn do độ tan tan của BaSO4 là 0,0028 g/100 g nước còn độ tan của CaSO4 là 0,2 g/100 g nước.
2. Nhận biết ion
1. Phương trình hoá học của các phản ứng xảy ra trong thí nghiệm:
Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2NaCl(aq)
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
2.
|
Bước tiến hành |
Hiện tượng |
Giải thích |
|
- Cho khoảng 1 mL dung dịch Na2CO3 1 M vào ống nghiệm, thêm tiếp khoảng 1 mL dung dịch CaCl2 1 M, lắc đều. |
Xuất hiện kết tủa trắng. |
Na2CO3 phản ứng với CaCl2 sinh ra chất kết tủa là CaCO3 có màu trắng. Na2CO3(aq) + CaCl2(aq) → CaCO3(s) + 2NaCl(aq) |
|
- Thêm tiếp 2 mL dung dịch HCl 2 M vào ống nghiệm, lắc đều. |
Kết tủa tan dần, có khí thoát ra. |
Tiếp tục thêm HCl vào ống nghiệm, HCl phản ứng với CaCO3 tạo thành muối tan là CaCl2 và giải phóng khí CO2. CaCO3(s) + 2HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l) |
Lý thuyết Hợp chất của kim loại nhóm IIA
1. Đặc điểm chung
- Tính tan trong nước của một số hợp chất nhóm IIA:
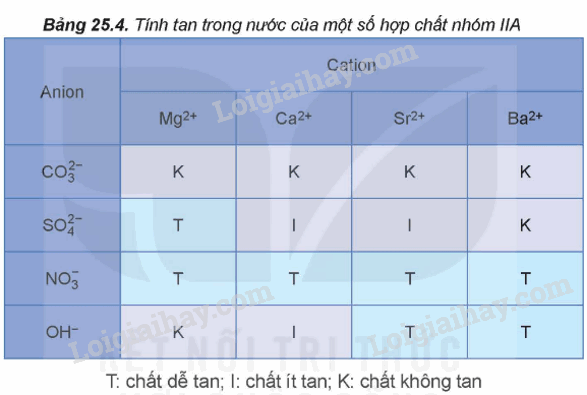
- Khi đốt nóng các kim loại nhóm IIA hoặc hợp chất của chúng trong ngọn lửa không màu làm ngọn lửa có màu đặc trưng: Ca2+ màu đỏ cam, Sr2+ màu đỏ son, Ba2+ màu lục.
2. Một số hợp chất quan trọng
a) Muối carbonate và nitrate
+ Tác dụng với acid
Ví dụ: MCO3 + 2HCl → MCl2 + CO2 + H2O
+ Phản ứng nhiệt phân
Ví dụ: 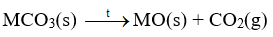
- Tương tự muối carbonate, các muối nitrate của kim loại nhóm IIA cũng đều bị phân hủy nhiệt tạo thành oxide.
b) Nhận biết từng ion riêng rẽ Ca2+, Ba2+, SO42-, CO32- trong dung dịch.
3. Ứng dụng
Các nguyên liệu, vật liệu chứa calcium như đá vôi, vôi, nước vôi, thạch cao, quặng apatite, quặng fluorite,… có nhiều ứng dụng trong đời sống và sản xuất.

- Một số hợp chất của calcium còn có vai trò quan trọng đối với cơ thể con người như calcium phosphate, hydroxylapatite tham gia cấu tạo xương và răng.
Xem thêm lời giải bài tập Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Hoạt động thí nghiệm trang 120 Hóa học 12: So sánh độ tan giữa calcium sulfate và barium sulfate...
Câu hỏi 2 trang 121 Hóa học 12: Đề xuất cách phân biệt 3 dung dịch bão hoà: CaCl2, SrCl2, BaCl2....
Câu hỏi 5 trang 124 Hóa học 12: Trình bày về tác hại của nước cứng với sản xuất và đời sống....
Xem thêm các bài giải bài tập Hóa Học lớp 12 Kết nối tri thức hay, chi tiết khác: