Lời giải bài tập Hóa học lớp 12 Bài 28: Sơ lược về phức chất sách Kết nối tri thức hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 28: Sơ lược về phức chất
Lời giải:
- Phức chất là hợp chất có chứa nguyên tố trung tâm (thường được kí hiệu là M) và các phối tử (thường được kí hiệu là L). Trong đó, nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử. Phối tử là anion hoặc phân tử. Phức chất có thể mang điện tích hoặc không mang điện tích.
- Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp: Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hoá trị kiểu cho – nhận, hình thành phức chất aqua.
(a) Hãy cho biết phối tử và nguyên tử trung tâm trong mỗi phức chất trên.
(b) Hãy cho biết số lượng phối tử có trong mỗi phức chất trên.
(c) Hãy cho biết điện tích của mỗi phức chất trên.
Lời giải:
|
Phức chất |
[Cu(H2O)6]2+ |
[CoF6]3- |
[Ni(CO)4] |
[PtCl2(NH3)2] |
|
Phối tử |
H2O |
F− |
CO |
Cl−, NH3 |
|
Nguyên tử trung tâm |
Cu2+ |
Co3+ |
Ni |
Pt |
|
Số lượng phối tử |
6 |
6 |
4 |
4 |
|
Điện tích phức chất |
+2 |
−3 |
0 |
0 |
Lời giải:
Hoạt động 2 trang 135 Hóa học 12: Hãy dự đoán dạng hình học của phức chất [Cu(H2O)6]2+.
Lời giải:
Dự đoán dạng hình học của phức chất [Cu(H2O)6]2+ là dạng bát diện do có 6 phối tử L.
Câu hỏi 2 trang 136 Hóa học 12: Cho các phức chất sau: [Ag(NH3)2]+ và [CoF6]3-.
Hãy chỉ ra nguyên tử trung tâm, phối tử và giải thích sự hình thành liên kết trong mỗi phức chất trên.
Lời giải:
|
Phức chất |
[Ag(NH3)2]+ |
[CoF6]3- |
|
Nguyên tử trung tâm |
Ag+ |
Co3+ |
|
Phối tử |
NH3 |
F− |
|
Giải thích sự hình thành liên kết trong phức chất |
Liên kết trong phức chất [Ag(NH3)2]+ được hình thành do phối tử NH3 cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Ag+. |
Liên kết trong phức chất [CoF6]3- được hình thành do phối tử F- cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Co3+. |
Câu hỏi 3 trang 136 Hóa học 12: Phức chất aqua của Ni2+ và Zn2+ đều có dạng hình học bát diện.
a) Viết công thức hoá học của mỗi phức chất aqua trên.
b) Mô tả sự hình thành liên kết giữa phối tử và nguyên tử trung tâm của mỗi phức chất trên.
Lời giải:
a) Công thức hoá học của 2 phức chất aqua: [Ni(H2O)6]2+; [Zn(H2O)6]2+.
b) Mô tả sự hình thành liên kết giữa phối tử và nguyên tử trung tâm của mỗi phức chất:
+ Trong dung dịch, ion Ni2+ nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hoá trị kiểu cho – nhận, hình thành phức chất aqua.
+ Trong dung dịch, ion Zn2+ nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hoá trị kiểu cho – nhận, hình thành phức chất aqua.
- Giải thích được sự hình thành phức chất aqua của ion kim loại chuyển tiếp và H2O trong dung dịch nước.
Lời giải:
- Ví dụ nguyên tử trung tâm, phối tử, dạng hình học của một số phức chất:
|
Phức chất |
[Cu(H2O)6]2+ |
[CoF6]3- |
[Ni(CO)4] |
[PtCl2(NH3)2] |
|
Phối tử |
H2O |
F− |
CO |
Cl−, NH3 |
|
Nguyên tử trung tâm |
Cu2+ |
Co3+ |
Ni |
Pt |
|
Dạng hình học |
Bát diện |
Bát diện |
Vuông phẳng |
Vuông phẳng |
- Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp: Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hoá trị kiểu cho – nhận, hình thành phức chất aqua.
Lý thuyết Sơ lược về phức chất
I. Một số khái niệm cơ bản về phức chất
- Phức chất là hợp chất có chứa nguyên tử trung tâm (thường được kí hiệu là M) và các phối tử (thường được kí hiệu là L). Trong đó, nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử.
- Phối tử là anion hoặc phân tử. Phức chất có thể mang điện tích hoặc không mang điện tích.
- Trong công thức phức chất, nguyên tử trung tâm M và các phối tử L thường được đặt trong móc vuông.
Ví dụ: Phức chất [Co(NH3)6]3+ có điện tích là +3, nguyên tử trung tâm là Co3+ và phối tử là NH3.
II. Một số dạng hình học của phức chất
Trong phức chất [MLn] (điện tích đã được lược bỏ), các phối tử L sắp xếp một các xác định xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau, phổ biến là dạng tứ diện, vuông phẳng và bát diện.
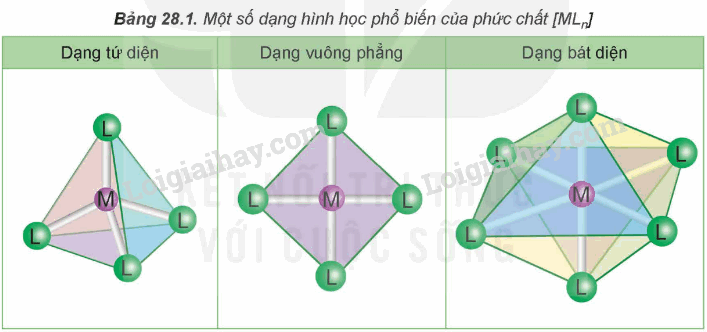
III. Liên kết trong phức chất
1. Liên kết giữa nguyên tử trung tâm và phối tử
- Liên kết hóa học giữa nguyên tử trung tâm M và phối tử L trong phức chất là liên kết cho – nhận, được hình thành nhờ sự cho cặp electron chưa liên kết của phối tử vào orbital trống của nguyên tử trung tâm.
2. Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp.
- Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hóa trị kiểu cho – nhận, hình thành phức chất aqua.
Sơ đồ tư duy Sơ lược về phức chất
Xem thêm các bài giải bài tập Hóa Học lớp 12 Kết nối tri thức hay, chi tiết khác:
Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất
Bài 29. Một số tính chất và ứng dụng của phức chất