Với giải Thí nghiệm 1 trang 138 Hóa học lớp 12 Cánh diều chi tiết trong Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Thí nghiệm 1 trang 138 Hóa học 12: Xác định nồng độ của dung dịch FeSO4 bằng dung dịch KMnO4 (dung dịch thuốc tím)
Chuẩn bị:
- Hoá chất: Dung dịch thuốc tím KMnO4 có nồng độ chính xác 0,02 M, dung dịch FeSO4 có nồng độ khoảng 0,1 M; dung dịch H2SO4 20%.
- Dụng cụ : Burette loại 25 mL, bình tam giác loại 100 mL.
Tiến hành:
Hình 20.1. Bộ dụng cụ thí nghiệm chuẩn độ muối FeSO4 trong môi trường acid bằng dung dịch thuốc tím
- Lắp bộ dụng cụ như Hình 20.1. Cho dung dịch thuốc tím vào burette đến vạch 0, đồng thời bảo đảm không còn bọt khí trong burette. Cho 10 mL dung dịch FeSO4 và 5 mL dung dịch H2SO4 20% vào bình tam giác.
- Mở khoá để nhỏ từ từ từng giọt dung dịch thuốc tím vào bình tam giác, đồng thời lắc đều bình.
- Tiếp tục nhỏ dung dịch thuốc tím (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt bởi một giọt thuốc tím dư, không mất màu trong khoảng 20 giây thì kết thúc chuẩn độ (khoá burette).
- Ghi lại thể tích dung dịch thuốc tím đã dùng.
Lặp lại thí nghiệm ít nhất hai lần nữa.
Yêu cầu: Xác định nồng độ của dung dịch FeSO4. Biết phương trình hoá học của phản ứng diễn ra trong quá trình chuẩn độ là:
5Fe2+(aq) + (aq) + 8H+(aq) →5Fe3+(aq) + Mn2+(aq) + 4H₂O(1)
Lời giải:
Gọi thể tích dung dịch KMnO4 đã dùng ở các lần đo lần lượt là V1, V2, …, Vn
Ta có thể tích trung bình của dung dịch KMnO4 là:
Theo phương trình chuẩn độ, ta có:
⇒
Thay số liệu vào công thức trên ta xác định được nồng độ của dung dịch FeSO4.
Lý thuyết Khái quát về kim loại chuyển tiếp dãy thứ nhất
1. Đặc điểm cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố có số hiệu nguyên tử từ 21 (Sc) đến 29 (Cu), thuộc chu kì 4.
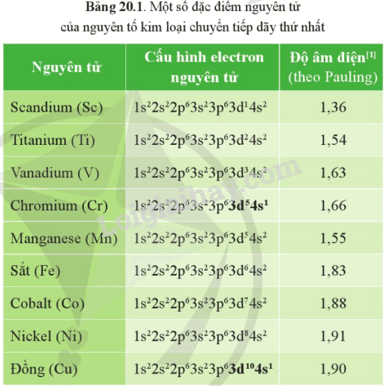
- Cấu hình electron nguyên tử của các nguyên tố trong dãy từ Sc đến Cu có xu hướng xếp đều electron ở phân lớp 4s và tăng dần số electron ở phân lớp 3d. Cấu hình electron của nguyên tử Cr và nguyên tử Cu là ngoại lệ.
- Nguyên tử của kim loại chuyển tiếp dãy thứ nhất có electron hóa trị ở phân lớp 4s và phân lớp 3d.
2. Số oxi hóa và màu sắc của các ion kim loại chuyển tiếp dãy thứ nhật
Do có nhiều electron hóa trị, đồng thời có độ âm điện nhỏ nên nguyên tử của nguyên tố kim loại chuyển tiếp thể hiện nhiều số oxi hóa dương khác nhau.
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Thí nghiệm 2 trang 138 Hóa học 12: Kiểm tra sự có mặt của cation Cu2+ hoặc Fe3+ trong dung dịch...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch