Với giải sách bài tập Hóa học 12 Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 12. Mời các bạn đón xem:
Sách bài tập Hóa học 12 Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 20.1 trang 65 Sách bài tập Hóa học 12: Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố chuyển tiếp dãy thứ nhất được xếp ở
A. chu kì 3.
B. chu kì 4.
C. chu kì 5.
D. chu kì 3 và chu kì 4.
Lời giải:
Đáp án đúng là: B
Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố chuyển tiếp dãy thứ nhất được xếp ở chu kì 4.
Bài 20.2 trang 65 Sách bài tập Hóa học 12: Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở
A. phân lớp 3d và phân lớp 4s.
B. phân lớp 3d.
C. lớp 4s.
D. phân lớp 3p và phân lớp 3d.
Lời giải:
Đáp án đúng là: A
Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở phân lớp 3d và phân lớp 4s.
Bài 20.3 trang 65 Sách bài tập Hóa học 12: Cho phát biểu "Nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều hợp chất mà trong đó chúng có các số oxi hoá dương khác nhau, đó là do nguyên tố này có ...(1)... và nguyên tử của chúng có ...(2)...."
Cụm từ cần điền vào (1) và (2) lần lượt là:
A. độ âm điện bé, nhiều electron hoá trị.
B. độ âm điện lớn, nhiều electron hoá trị.
C. điện tích hạt nhân lớn, bán kính bé.
D. bán kính bé, điện tích hạt nhân lớn.
Lời giải:
Đáp án đúng là: A
"Nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều hợp chất mà trong đó chúng có các số oxi hoá dương khác nhau, đó là do nguyên tố này có độ âm điện bé và nguyên tử của chúng có nhiều electron hóa trị"
Bài 20.4 trang 65 Sách bài tập Hóa học 12: Theo IUPAC, nguyên tố chuyển tiếp là những nguyên tố có phân lớp d chưa được xếp (hoặc điền) đầy electron ở trạng thái nguyên tử hoặc ở trạng thái ion. Mỗi phát biểu dưới đây đúng hay sai?
(a) Calcium không phải là nguyên tố chuyển tiếp do không có phân lớp d trong cấu hình electron của nguyên tử.
(b) Nguyên tố có Z = 30 là nguyên tố chuyển tiếp.
(c) Nguyên tố có Z = 29 không phải là nguyên tố chuyển tiếp.
(d) Nguyên tố chuyển tiếp có tính kim loại nên còn được gọi là nguyên tố kim loại chuyển tiếp.
Lời giải:
(a) Đúng. Calcium có số hiệu nguyên tử là 20, trong khi đó các kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố có số hiệu nguyên tử từ 21 đến 29.
(b) Sai vì các kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố có số hiệu nguyên tử từ 21 đến 29.
(c) Sai vì Z=29 có cấu hình electron là [Ar]3d104s1 thuộc nguyên tố d là kim loại chuyển tiếp.
(d) Đúng.
Bài 20.5 trang 66 Sách bài tập Hóa học 12: Từ kết quả phân tích phổ phát xạ nguyên tử của chromium (Z = 24) dẫn đến nhận định rằng nguyên từ này phải có 6 electron độc thân.
Mỗi phát biểu dưới đây đúng hay sai?
(a) Nếu nguyên tử chromium có 6 electron độc thân thì nguyên tử này chứa 6 ô orbital nguyên tử mà trong mỗi ô này chỉ có 1 electron.
(b) Theo các quy ước về viết cấu hình electron thì cấu hình electron của nguyên tử chromium là [Ar]3d34s14p1.
(c) Cấu hình electron của nguyên tử là [Ar]3d54s1 sẽ phù hợp với nhận định từ phổ phát xạ của nguyên tử chromium.
(d) Cấu hình electron của nguyên tử phải luôn phù hợp với các quy ước về viết cấu hình electron.
Lời giải:
(a) Đúng.
(b) Sai vì cấu hình electron của nguyên tử chromium là [Ar]3d34s14p1.
(c) Đúng
(d) Sai vì cấu hình electron của nguyên tử có thể không tuân theo các quy tắc khi ở trạng thái kích thích.
Bài 20.6 trang 66 Sách bài tập Hóa học 12: Những đặc điểm nào sau đây là của nguyên tố kim loại chuyển tiếp dãy thứ nhất?
(a) Có các electron hoá trị phân bố cả trên phân lớp 3d và phân lớp 4s.
(b) Từ 21Sc đến29Cu, số electron trong phân lớp d có xu hướng tăng dần (trừ trường hợp ngoại lệ).
(c) Thể hiện nhiều số oxi hoá dương hoặc âm trong các hợp chất.
(d) Tạo nên nhiều cation và anion có điện tích khác nhau.
Lời giải:
(a) Đúng.
(b) Đúng.
(c) Sai vì nguyên tố kim loại chuyển tiếp thể hiện nhiều số oxi hóa dương khác nhau.
(d) Sai vì nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều cation khác nhau.
Bài 20.7 trang 66 Sách bài tập Hóa học 12: Số electron hoá trị của nguyên tử sắt (Z = 26) là bao nhiêu?
Lời giải:
Fe có cấu hình e là [Ar]3d64s2 ⇒ có 8 electron hoá trị.
Bài 20.8 trang 66 Sách bài tập Hóa học 12: Số electron độc thân của nguyên tử cobalt (Z = 27) là bao nhiêu?
Lời giải:
Co có cấu hình e là [Ar]3d74s2
⇒ Biểu diễn cấu hình electron theo orbital:
Vậy Co có 3 electron độc thân.
Bài 20.9 trang 66 Sách bài tập Hóa học 12: Hợp chất Fe3O4 được gọi là oxide sắt từ do có từ tính mạnh. Chất này còn có tên gọi là iron(II, III) oxide do đây là hỗn hợp của FeO và Fe2O3 theo tỉ lệ mol 1:1.
a) Theo quá trình:
thì số mol HCl trong dung dịch hydrochloric acid cần để hoà tan vừa đủ 1 mol Fe3O4 là bao nhiêu?
b) Trong tự nhiên, Fe3O4 là thành phần chính của khoáng vật magnetite, được dùng tạo sắt nóng chảy trong quá trình sản xuất thép.
(b1) Viết phương trình hoá học của phản ứng xảy ra khi khử Fe3O4 thành sắt bởi carbon monoxide ở nhiệt độ cao.
(b2) Trong phản ứng trên, số electron mà 1 phân tử Fe3O4 cần nhận để tạo thành sắt là bao nhiêu?
Lời giải:
(a)
1 8 mol
Số mol HCl cần để hòa tan vừa đủ 1 mol Fe3O4 là: 8 mol
(b)
(b1) Phương trình hóa học: Fe3O4+4CO 3Fe+4CO2
(b2)
Số electron cần nhận: 8 electron.
Bài 20.10 trang 67 Sách bài tập Hóa học 12: Giải thích vì sao:
a) số oxi hoá lớn nhất của nguyên tố manganese là +7 ?
b) hợp chất KMnO4 có tính oxi hoá mạnh?
c) số oxi hoá lớn nhất của nguyên tố chromium là +6 ?
d) hợp chất K2CrO4 có tính oxi hoá mạnh?
e) sắt là nguyên tố chuyển tiếp?
g) trong tự nhiên, cation Fe3+ thường phổ biến hơn cation Fe2+?
h) cation Fe2+ có cả tính oxi hoá và tính khử?
Lời giải:
(a) Số oxi hóa lớn nhất của nguyên tố manganese là +7 do cấu hình electron của Mn là [Ar]3d54s2, khi mất hết 7 electron hóa trị sẽ đạt số oxi hóa +7.
(b) Hợp chất KMnO4 có tính oxi hóa mạnh do Mn ở trạng thái oxi hóa +7 (cao nhất) rất không bền và dễ bị khử.
(c) Số oxi hóa lớn nhất của nguyên tố chromium là +6 vì cấu hình electron của Cr là [Ar]3d54s1, khi mất 6 electron hóa trị sẽ đạt số oxi hóa +6.
(d) Hợp chất K2CrO4 có tính oxi hóa mạnh do Cr ở trạng thái oxi hóa +6 (cao nhất) rất không bền và dễ bị khử.
(e) Sắt là nguyên tố chuyển tiếp do nó có phân lớp d chưa điền đầy electron.
(g) Trong tự nhiên, cation Fe3+ phổ biến hơn Fe2+ do Fe3+ có năng lượng ổn định hơn.
(h) Cation Fe2+ có cả tính oxi hóa và tính khử vì nó có thể mất thêm electron để trở thành Fe3+ hoặc nhận electron để trở thành Fe.
Bài 20.11 trang 67 Sách bài tập Hóa học 12: Tìm hiểu, cho biết những phát biểu nào sau đây là đúng.
(a) Ở dạng đơn chất, sắt là kim loại nặng, có độ hoạt động hoá học mạnh.
(b) Sắt ít được sử dụng ở dạng nguyên chất. Sắt chủ yếu được sử dụng ở dạng hợp kim (thép thường, inox,...).
(c) Đinh đóng gỗ được làm bằng thép nhưng vẫn bị gi sét do ăn mòn điện hoá.
(d) Số oxi hoá của sắt trong các hợp chất FeO, Fe2O3 và FeO(OH).H2O lần lượt là +2, +3 và +3.
(e) Thành phần chính của gỉ sét, của váng nâu đỏ ở vùng nước nhiễm phèn là FeO(OH).H2O hay Fe(OH)3.
Lời giải:
(a) Sai, sắt là kim loại có mức độ hoạt động trung bình.
(b) Đúng.
(c) Đúng.
(d) Đúng.
(e) Đúng.
Bài 20.12 trang 67 Sách bài tập Hóa học 12: Giải thích vì sao:
a) có thể phân biệt các dung dịch CuSO4, CoSO4, FeSO4, NiSO4 và CrSO4 thông qua quan sát?
b) có thể phân biệt được hai muối K2CrO4 và K2Cr2O7 thông qua quan sát?
c) có thể nhận biết cation Cu2+ trong dung dịch bằng dung dịch base?
d) có thể nhận biết cation Fe3+ trong dung dịch bằng dung dịch base?
Lời giải:
(a) Các dung dịch CuSO4, CoSO4, FeSO4, NiSO4 và CrSO4 có thể phân biệt thông qua quan sát vì mỗi dung dịch có màu sắc đặc trưng.
(b) Có thể phân biệt được hai muối K2CrO4 và K2Cr2O7 thông qua quan sát vì K2CrO4 có màu vàng và K2Cr2O7 có màu cam.
(c) Có thể nhận biết cation Cu2+ trong dung dịch bằng dung dịch base vì tạo Cu(OH)2 kết tủa màu xanh.
Cu2+ + 2OH- → Cu(OH)2
(d) Có thể nhận biết cation Fe3+ trong dung dịch bằng dung dịch base vì tạo Fe(OH)3 kết tủa màu nâu đỏ.
Fe3+ + 3OH- → Fe(OH)3
Bài 20.13 trang 67 Sách bài tập Hóa học 12: Hoà tan 0,422 gam mẫu khoáng vật của sắt trong dung dịch sulfuric acid dư, sao cho tất cả lượng sắt có trong quặng đều chuyển thành Fe2+, thu được dung dịch A. Chuẩn độ Fe2+ trong dung dịch A bằng chất chuẩn là dung dịch thuốc tím KMnO4 0,040M. Khi đã sử dụng 23,50 mL thì phản ứng vừa qua điểm tương đương.
Mỗi phát biểu dưới đây là đúng hay sai?
(a) Nếu chỉ có Fe2+ trong dung dịch A tác dụng được với thuốc tím thì việc chuẩn độ dung dịch A sẽ giúp xác định được lượng nguyên tố sắt trong mẫu khoáng vật. Từ đó tính được % (theo khối lượng) của nguyên tố sắt có trong mẫu khoáng vật là 60,26 %.
(b) Trong quá trình chuẩn độ trên, cần nhỏ từ từ dung dịch thuốc tím từ burette vào bình tam giác chứa dung dịch A.
(c) Cần thêm chất chỉ thị phù hợp vào bình tam giác chứa dung dịch A để xác định được thời điểm kết thúc quá trình chuẩn độ.
(d) Cần lặp lại thí nghiệm chuẩn độ 2 lần để bảo đảm tính chính xác của kết quả.
Lời giải:
(a) Sai vì:
5Fe2+(aq) + MnO4− (aq) +8H+(aq) →5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
Số mol anion MnO4- là:
Từ phương trình hóa học:
Khối lượng sắt trong mẫu khoáng vật bằng khối lượng Fe2+ đã phản ứng với thuốc tím và là:
Phần trăm theo khối lượng của Fe trong mẫu khoáng vật là:
(b) Đúng
(c) Sai, không cần chất chỉ thị vì KMnO4 là chất tự chỉ thị.
(d) Sai, cần lặp lại thí nghiệm ít nhất 3 lần.
Bài 20.14 trang 68 Sách bài tập Hóa học 12: Cho các thông tin sau:
|
Cặp oxi hoá – khử |
Thế điện cực chuẩn (V) |
|
Fe3+/Fe2+ |
-0,77 |
|
Cr2O72- +14H+/2Cr3+ + 7H2O |
1,33 |
|
MnO4- +8H+/Mn2+ + 4H2O |
1,53 |
Biết có màu cam và Cr3+ (aq) có màu xanh lá cây.
Mỗi phát biểu dưới đây đúng hay sai?
(a) Trong môi trường acid, anion (từ sự phân li của muối potassium dichromate, K2Cr2O7) có tính oxi hoá mạnh hơn anion (từ sự phân li của muối KMnO4).
(b) Chuẩn độ được Fe2+ trong dung dịch gồm và H+ bằng dung dịch chứa chất chuẩn là KMnO4.
(c) Không chuẩn độ được Fe2+ trong dung dịch gồm và H+ bằng dung dịch chứa chất chuẩn là K2Cr2O7.
(d) Có diễn ra phản ứng oxi hoá - khử theo phương trình hoá học sau:
Lời giải:
(a) Sai do cặp oxi hóa khử MnO4- +8H+/Mn2+ + 4H2O có thế điện cực chuẩn cao hơn cặp Cr2O72- +14H+/2Cr3+ + 7H2O.
(b) Đúng vì chỉ có Fe2+ tác dụng với thuốc tím.
(c) Sai vì trong môi trường acid, K2Cr2O7 là chất oxi hóa mạnh và có màu.
(d) Sai vì phương trình phản ứng không đúng.
Bài 20.15 trang 68 Sách bài tập Hóa học 12: Dựa vào Bảng 20.4 (sách Hoá học 12, bộ sách Cánh Diều), hãy chỉ ra những phát biểu đúng.
(a) Các kim loại chuyển tiếp thường cứng và khó nóng chảy.
(b) Các kim loại chuyển tiếp được xếp vào nhóm kim loại nhẹ.
(c) So với calcium (là kim loại s), các kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng, độ cứng và nhiệt độ nóng chảy thấp hơn.
(d) Nhờ có độ cứng cao, đồng thời bền trước tác động của các tác nhân ăn mòn nên chromium được dùng làm lớp bảo vệ chống ăn mòn cho các dụng cụ, máy móc, thiết bị, đồ gia dụng,...
(e) Do có độ cứng vừa phải và dẫn điện tốt nên đồng được sử dụng làm dây dẫn trong các thiết bị và mạng lưới điện gia dụng.
Lời giải:
Các phát biểu (a), (d), (e) đúng.
(b) Sai vì kim loại chuyển tiếp thường là kim loại nặng.
(c) Sai so với calcium (là kim loại s), các kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng, độ cứng và nhiệt độ nóng chảy cao hơn.
Lý thuyết Sơ lược về kim lại chuyển tiếp dãy thứ nhất
I. Khái quát về kim loại chuyển tiếp dãy thứ nhất
1. Đặc điểm cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại chuyển tiếp dãy thứ nhất gồm các nguyên tố có số hiệu nguyên tử từ 21 (Sc) đến 29 (Cu), thuộc chu kì 4.
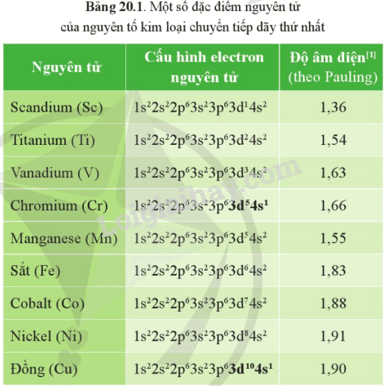
- Cấu hình electron nguyên tử của các nguyên tố trong dãy từ Sc đến Cu có xu hướng xếp đều electron ở phân lớp 4s và tăng dần số electron ở phân lớp 3d. Cấu hình electron của nguyên tử Cr và nguyên tử Cu là ngoại lệ.
- Nguyên tử của kim loại chuyển tiếp dãy thứ nhất có electron hóa trị ở phân lớp 4s và phân lớp 3d.
2. Số oxi hóa và màu sắc của các ion kim loại chuyển tiếp dãy thứ nhật
Do có nhiều electron hóa trị, đồng thời có độ âm điện nhỏ nên nguyên tử của nguyên tố kim loại chuyển tiếp thể hiện nhiều số oxi hóa dương khác nhau.
II. Tính chất vật lí của kim loại chuyển tiếp.
1. Tính chất vật lí
- Các kim loại chuyển tiếp thường có khối lượng riêng lớn, cứng và khó nóng chảy.
- Kim loại chuyển tiếp dãy thứ nhất và kim loại họ s thuộc cùng chu kì thường có sự khác biệt đáng kể về một số tính chất vật lí. Chẳng hạn so với potassium và calcium:
+ Các kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng, độ cứng và nhiệt độ nóng chảy cao hơn.
+ Các kim loại chuyển tiếp dãy thứ nhất có khả năng dẫn điện thấp hơn.
2. Một số ứng dụng từ tính chất vật lí
+ Do có độ cứng vừa phải nên đồng dễ gia công tạo các sản phẩm.
+ Nhờ có độ cứng cao đồng thời bền trước tác động của các tác nhân ăn mòn nên Cr được dùng làm lớp bảo vệ chống ăn mòn cho các dụng cụ, máy móc, thiết bị,…
+ Ứng dụng phổ biến của kim loại chuyển tiếp là tạo ra các hợp kim có tính chất đáp ứng nhiều mục đích sử dụng khác nhau.
Xem thêm các bài giải SBT Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19: Nước cứng và làm mềm nước cứng
Bài 20: Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch