Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 11 Bài 7: Sulfuric acid và muối sulfate sách Cánh diều. Bài viết gồm 15 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 11. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 7: Sulfuric acid và muối sulfate. Mời các bạn đón xem:
Trắc nghiệm Hóa học 11 Bài 7: Sulfuric acid và muối sulfate
Phần 1. Trắc nghiệm Sulfuric acid và muối sulfate
Câu 1. Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
A. Ba(OH)2.
B. BaCl2.
C. Ba(NO3)2.
D. MgCl2.
Đáp án đúng là: D
MgCl2 không tác dụng với K2SO4 do đó không thể dùng MgCl2 để nhận ra ion
Câu 2. Nhóm gồm tất cả các kim loại tác dụng với dung dịch H2SO4 đặc, nóng nhưng không tác dụng với dung dịch H2SO4 loãng là
A. Hg, Ag, Cu.
B. Al, Fe, Cr.
C. Ag, Fe, Pt.
D. Al, Cu, Au.
Đáp án đúng là: A
Hg, Ag, Cu đứng sau H trong dãy hoạt động hoá học của kim loại nên không tác dụng với H2SO4 loãng; Tuy nhiên Hg, Ag, Cu tác dụng được với H2SO4 đặc.
Câu 3. Cho phản ứng: H2SO4 + Fe → Fe2(SO4)3 + H2O + SO2
Số phân tử H2SO4 bị khử và số phân tử H2SO4 tạo muối của phản ứng sau khi cân bằng là
A. 6 và 3.
B. 3 và 6.
C. 6 và 6.
D. 3 và 3.
Đáp án đúng là: D
6H2SO4 + 2Fe → Fe2(SO4)3 + 6H2O + 3SO2
Vậy số phân tử H2SO4 bị khử và số phân tử H2SO4 tạo muối của phản ứng sau khi cân bằng là 3 và 3.
Câu 4. Phản ứng nào sau đây không xảy ra?
A. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2.
B. 2Na + H2SO4 → Na2SO4 + H2.
C. Cu + H2SO4 → CuSO4 + H2.
D. Zn + H2SO4 → ZnSO4 + H2.
Đáp án đúng là: C
Cu đứng sau H trong dãy hoạt động hoá học nên không tác dụng với H2SO4 loãng.
Câu 5. Cho các chất: S, SO2, H2S, H2SO4. Số chất vừa có tính oxi hoá, vừa có tính khử là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: C
S, SO2, H2S vừa có tính oxi hoá, vừa có tính khử.
+ Trong đơn chất S thì S có số oxi hóa 0, đây là số oxi hóa trung gian, do đó S vừa có tính oxi hóa, vừa có tính khử.
+ Trong SO2 thì S có số oxi hóa +4, đây là số oxi hóa trung gian của lưu huỳnh (sulfur), do đó SO2 vừa có tính oxi hóa, vừa có tính khử.
+ Trong H2S, tính khử gây ra bởi S-2; tính oxi hóa gây ra bởi H+1.
Câu 6. Để pha loãng dung dịch H2SO4 đặc, người ta dùng cách nào sau đây?
A. Rót nhanh dung dịch H2SO4 đặc vào nước.
B. Rót từ từ nước vào dung dịch H2SO4 đặc.
C. Rót từ từ dung dịch H2SO4 đặc vào nước, khuấy đều.
D. Rót nhanh nước vào H2SO4 đặc, đun nóng.
Đáp án đúng là: C
Để đảm bảo an toàn khi pha loãng H2SO4 đặc, người ta tiến hành cho từ từ H2SO4 đặc vào nước và khuấy đều nhẹ bằng đũa thuỷ tinh. Tuyệt đối không làm ngược lại.
Câu 7. Acid H2SO4 loãng tác dụng với Fe tạo thành sản phẩm là
A. Fe2(SO4)3 và H2.
B. FeSO4 và H2.
C. FeSO4 và SO2.
D. Fe2(SO4)3 và SO2.
Đáp án đúng là: B
Fe + H2SO4 loãng → FeSO4 + H2
Câu 8. Các khí sinh ra trong thí nghiệm phản ứng của saccharose (C12H22O11) với dung dịch H2SO4 đặc bao gồm:
A. H2S và CO2.
B. H2S và SO2.
C. SO3 và CO2.
D. SO2 và CO2.
Đáp án đúng là: D
C12H22O11 12C + 12H2O
Một phần C bị oxi hoá theo phản ứng:
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O
Câu 9. Nhóm kim loại nào sau đây không tác dụng với H2SO4 loãng?
A. Zn, Al.
B. Na, Mg.
C. Cu, Hg.
D. Mg, Fe.
Đáp án đúng là: C
Cu, Hg đứng sau H trong dãy hoạt động hoá học của kim loại nên không tác dụng với H2SO4 loãng.
Câu 10. Hai chất nào sau đây khi trộn với nhau có thể xảy ra phản ứng hóa học?
A. S + H2SO4 đặc.
B. CO2 + BaCl2.
C. FeCl2 + H2S.
Đáp án đúng là: A
S + 2H2SO4 đặc → 3SO2 + 2H2O
Câu 11. Dãy gồm tất cả các chất đều tác dụng với dung dịch H2SO4 loãng là
A. Fe3O4, BaCl2, NaCl, Al, Cu(OH)2.
B. Fe(OH)2, Na2CO3, Fe, CuO, NH3.
C. CaCO3, Cu, Al(OH)3, MgO, Zn.
D. Zn(OH)2, CaCO3, CuS, Al, Fe2O3.
Đáp án đúng là: B
Fe(OH)2, Na2CO3, Fe, CuO, NH3 đều tác dụng với dung dịch H2SO4 loãng.
Phát biểu A: Loại BaCl2, NaCl.
Phát biểu C: Loại Cu.
Phát biểu D: Loại CuS.
Câu 12. Có các thí nghiệm sau:
(a) Nhúng thanh sắt (iron) vào dung dịch H2SO4 loãng, nguội.
(b) Sục khí SO2 vào nước bromine.
(c) Cho dung dịch BaCl2 tác dụng với dung dịch H2SO4 loãng.
(d) Nhúng lá nhôm (aluminium) vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hoá học là
A. 2.
B. 1.
C. 3.
D. 4.
Đáp án đúng là: C
Bao gồm: a, b, c
(a) Fe + H2SO4 → FeSO4 + H2↑
(b) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
(c) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Câu 13. Cho các chất: Cu, CuO, NaCl, Mg, KOH, C, Na2CO3. Số chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là
A. 3.
B. 4.
C. 5.
D. 6.
Đáp án đúng là: B
Các chất thoả mãn là: CuO; Mg; KOH; Na2CO3.
Câu 14. Cho các chất: C, Cu, ZnS, Fe2O3, CuO, NaCl rắn, Mg(OH)2. Có bao nhiêu chất tác dụng với H2SO4 đặc, nóng, tạo khí là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án đúng là: C
Bao gồm:
- Chất khử: C, Cu, ZnS.
- Muối: NaCl rắn .
2NaClrắn + H2SO4 đặc Na2SO4 + 2HCl↑
Câu 15. Cho các phát biểu sau:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
(c) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là ion Ba2+ trong BaCl2, Ba(OH)2, Ba(NO3)2.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án đúng là: D
Bao gồm: a, c, e.
(b) Sai vì khi pha loãng sulfuric acid đặc cần cho từ từ acid đặc vào nước.
(d) Sai vì sulfuric acid loãng khi tác dụng với kim loại có sinh ra khí hydrogen.
Phần 2. Lý thuyết Sulfuric acid và muối sulfate
I. Sulfuric acid
1. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo phân tử:
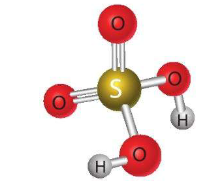
- Tính chất vật lí:
+ Là chất lỏng sánh như dầu, không màu, không bay hơi.
+ Dung dịch sulfuric acid đặc có khả năng hút ẩm.
2. Tính chất hóa học
a, Tính chất hóa học của dung dịch sulfuric acid loãng
+ Đổi màu quý tím thành đỏ
+ Tác dụng với kim loại hoạt động.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
b, Tính chất hóa học của dung dịch sulfuric acid đặc
- Tính oxi hóa mạnh
+ Oxi hóa hầu hết các kim loại (trừ vàng, platinium), nhiều phi kim như carbon, sulfur, phosphorus… và nhiều hợp chất
VD: H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
- Tính háo nước
+ Dung dịch sulfuric acid đặc hấp thụ mạnh nước.
3. Bảo quản và xử lí bỏng sulfuric acid
- Bảo quản: Chai, lọ đựng sulfuric acid phải để ở nơi ít có nguy cơ bị va chạm, xa nguồn nhiệt và các hóa chất khác.
- Xử lí bỏng sulfuric acid: Sơ cứu người bị bỏng bằng cách rửa vết bỏng dưới vòi nước sạch ít nhất 20 phút trước khi đưa đến cơ sở y tế.
+ Tuyệt đối không chườm đá lạnh, khong xoa vết bỏng bằng các loại kem, gel, dầu …
4. Ứng dụng và sản xuất sulfuric acid
a, Ứng dụng
- Sản xuất phân bón.
- Chất tẩy rửa, phẩm màu, thuốc trừ sâu…
b, Sản xuất sulfuric acid bằng phương pháp tiếp xúc
S(s) + O2(g) → SO2(g)
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
2SO2 + O2(g) → 2SO3
H2SO4(aq) + nSO3(g) → H2SO4.nSO3(l)
H2SO4.nSO3 (l) + nH2O → (n+1) H2SO4
II. Muối sulfate
1. Một số muối sulfate
- Muối sulfate đa số đều tan trong nước, CaSO4 rất ít tan, BaSO4 không tan trong nước.
- Ứng dụng của một số muối:
+ (NH4)2SO4: dùng làm phân bón cung cấp đạm.
+ MgSO4: Chủ yếu dùng làm phân bón.
+ CaSO4.2H2O (thạch cao tự nhiên); CaSO4.0,5H2O (thạch cao nung): hút nước, sử dụng trong vật liệu xây dựng, đúc tượng …
+ BaSO4: Sơn, mực in, nhựa, lớp phủ, men, …
2. Nhận biết ion SO42- trong dung dịch
Ba2+ + SO42- → BaSO4
Xuất hiện kết tủa trắng (BaSO4)
Sơ đồ tư duy Sulfuric acid và muối sulfate

Xem thêm các bài Trắc nghiệm Hóa học lớp 11 Cánh diều hay, chi tiết khác: